Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Lấy một ít muối trong mỗi lọ đem hoà tan vào nước được các dung dịch riêng biệt.
Dung dịch nào tác dụng được với Br 2 hoặc nước brom tạo ra tinh thể có màu đen tím, đó là dung dịch KI.
Br 2 + 2KI → 2KBr + I 2
Những dung dịch còn lại, dung dịch nào tác dụng được với Cl 2 tạo ra dung dịch có màu vàng nâu (màu của Br 2 tan trong nước), đó là dung dịch KBr.
Cl 2 + 2KBr → 2KCl + Br 2
Hai dung dịch còn lại là KF và KCl : cho tác dụng với dung dịch Ag NO 3 , dung dịch nào tạo kết tủa trắng, đó là dung dịch KCl.
KCl + Ag NO 3 → AgCl + K NO 3
Dung dịch còn lại là KF.

Điều chế HF, HCl bằng cách cho H 2 SO 4 đặc tác dụng với muối florua, clorua vì H 2 SO 4 à chất oxi hoá không đủ mạnh để oxi hoá được HF và HCl. Nói cách khác, HF và HCl có tính khử yếu, chúng không khử được H 2 SO 4 đặc
Ca F 2 + H 2 SO 4 → Ca SO 4 + 2HF
NaCl + H 2 SO 4 → NaH SO 4 + HCl
Nhưng không thể dùng phương pháp trên để điều chế HBr và HI vì H 2 SO 4 đặc oxi hoá được những chất này thành Br 2 và I 2 . Nói cách khác, HBr và HI là những chất có tính khử mạnh hơn HCl và HF.
NaBr + H 2 SO 4 → HBr + NaH SO 4
2HBr + H 2 SO 4 → Br 2 + SO 2 + 2 H 2 O
NaI + H 2 SO 4 → NaH SO 4 + HI
2HI + H 2 SO 4 → I 2 + SO 2 + 2 H 2 O

Đáp án B
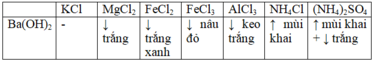
MgCl2 +Ba(OH)2 →Mg(OH)2 + BaCl2
FeCl2 +Ba(OH)2 →Fe(OH)2 + BaCl2
2FeCl3 +3Ba(OH)2 →2Fe(OH)3 + 3BaCl2
2AlCl3 +3Ba(OH)2 →2Al(OH)3 + 3BaCl2
2NH4Cl + Ba(OH)2 → 2NH3 + 2H2O + BaCl2
(NH4)2SO4 + Ba(OH)2 →2NH3 + 2H2O + BaSO4

Chọn đáp án C
HBr và HI có tính khử mạnh, có thể tác dụng với H 2 S O 4 đặc nên không thể điều chế theo phản ứng trên.

- Trích một ít các chất làm mẫu thử, hòa tan các chất vào nước
- Cho các dd tác dụng với quỳ tím:
+ QT chuyển đỏ: HCl, HBr (1)
+ QT chuyển xanh: KOH
+ QT không chuyển màu: KCl, KBr (2)
- Cho các dd ở (1) tác dụng với dd AgNO3
+ Xuất hiện kết tủa trắng: HCl
\(HCl+AgNO_3\rightarrow AgCl\downarrow+HNO_3\)
+ Xuất hiện kết tủa vàng nhạt: HBr
\(HBr+AgNO_3\rightarrow AgBr\downarrow+HNO_3\)
- Cho các dd ở (2) tác dụng với dd AgNO3
+ Xuất hiện kết tủa trắng: KCl
\(KCl+AgNO_3\rightarrow AgCl\downarrow+KNO_3\)
+ Xuất hiện kết tủa vàng nhạt: KBr
\(KBr+AgNO_3\rightarrow AgBr\downarrow+KNO_3\)



Điều chế halogen tương ứng từ muối đã cho :
Điều chế F 2 : Điện phân mưối KF tan trong chất lỏng HF khan thu được F 2 ở anôt.
Điều chế Cl 2 : Điện phân dung dịch KCl trong nước, có màng ngăn.
Điều chế Br 2 : Cho H 2 SO 4 đặc tác dụng với hỗn hợp rắn là KBr và Mn O 2 đun nóng. Các phản ứng xảy ra như sau :
2KBr + H 2 SO 4 → K 2 SO 4 + 2HBr (1)
Mn O 2 + 4HBr → Mn Br 2 + Br 2 + 2 H 2 O (2)
Mn Br 2 + H 2 SO 4 → Mn SO 4 + 2HBr (3)
Phản ứng tổng của (1), (2), (3) là :
2KBr + Mn O 2 + 2 H 2 SO 4 → K 2 SO 4 + Mn SO 4 + Br 2 + 2 H 2 O (4)
Điều chế I 2 tương tự điểu chế Br 2 và có phản ứng tổng là :
2KI + Mn O 2 + 2 H 2 SO 4 → K 2 SO 4 + Mn SO 4 + I 2 + 2 H 2 O (4)
- Điều chế các hiđro halogenua từ các muối tương ứng :
Điều chế HF: KF + H 2 SO 4 → KH SO 4 + HF
Điều chế HCl: KCl + H 2 SO 4 → KH SO 4 + HCl
Điều chế HBr : Điện phân dung dịch KBr có màng ngăn (hoặc cho Cl 2 tác dụng với dung dịch KBr, hoặc cho muối KBr tác dụng với hỗn hợp Mn O 2 và H 2 SO 4 đặc ) được Br 2 sau đó cho Br 2 ác dụng với H 2 ở nhiệt độ cao được HBr.
H 2 + Br 2 → 2HBr
Điều chế HI : Tương tự như điều chế HBr ở trên hoặc từ I 2 ta điều chế HI bằng cách dùng khí H 2 S và khử I 2
I 2 + H 2 S → 2Hi + S