Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 1 Hoàn thành PTHH:
\(1)2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2\downarrow+O_2\uparrow\\ 2)FeO+2HCl\rightarrow FeCl_2+H_2O\\ 3)Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\\ 4)4P+5O_2\underrightarrow{t^o}2P_2O_5\)
Câu 2
\(n_{Zn}=\dfrac{m}{M}=\dfrac{13}{65}=0,2\left(mol\right)\)
a) \(PTHH:Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
1 1 1 1
0,2 0,2 0,2 0,2
b) \(V_{H_2}=n.24,79=0,2.24,79=4,958\left(l\right)\)
c) \(m_{H_2SO_4}=n.M=0,2.\left(2+32+16.4\right)=19,6\left(g\right).\)
câu 1
(1)2KMnO4➞(to)K2MnO4+MnO2+O2
(2)FeO+2HCl➞FeCl2+H2O
(3)Fe2O3+3H2SO4➞Fe2(SO4)3+3H2O
(4)4P+5O2➞2P2O5
Câu2
a)PTHH:Zn+H2SO4➞ZnSO4+H2
b)nZn=\(\dfrac{13}{65}\)=0,2(m)
n\(_{H_2SO_4}\)=\(\dfrac{24,5}{98}\)=0,25(m)
PTHH : Zn + H2SO4 ➞ ZnSO4 + H2
tỉ lệ :1 1 1 1
số mol
ban đầu :0,2 0,25
ta có tỉ lệ:\(\dfrac{0,2}{1}\)<\(\dfrac{0,25}{1}\)->H2SO4 dư
PTHH : Zn+ H2SO4 ➞ + ZnSO4+H2
tỉ lệ :1 1 1 1
số mol :0,2 0,2 0,2 0,2
v\(_{H_2}\)=0,2.22,4=4,48(l)
c)m\(_{ZnSO_4}\)=0,2.161=32,2(g)
m\(_{H_2}\)=0,2.2=0,4(g)

\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\\ n_{HCl}=\dfrac{25,55}{36,5}=0,7\left(mol\right)\\a. 2Al+6HCl\rightarrow2AlCl_3+3H_2\\ b.Vì:\dfrac{0,2}{2}< \dfrac{0,7}{6}\\ \Rightarrow HCldư\\ n_{HCl\left(dư\right)}=0,7-\dfrac{6}{2}.0,2=0,1\left(mol\right)\\ n_{AlCl_3}=n_{Al}=0,2\left(mol\right)\\ n_{H_2}=\dfrac{3}{2}.0,2=0,3\left(mol\right)\\ m_{H_2}=0,3.2=0,6\left(g\right)\\ m_{HCl\left(dư\right)}=0,1.36,5=3,65\left(g\right)\\ m_{AlCl_3}=133,5.0,2=26,7\left(g\right)\)

$a\big)2Al+3H_2SO_4\to Al_2(SO_4)_3+3H_2$
$b\big)$
$n_{Al}=\dfrac{4,05}{27}=0,15(mol)$
$n_{H_2SO_4}=\dfrac{29,4}{98}=0,3(mol)$
Vì $\dfrac{n_{Al}}{2}<\frac{n_{H_2SO_4}}{3}\to H_2SO_4$ dư
$c\big)$
Theo PT: $n_{H_2}=\dfrac{3}{2}n_{Al}=0,225(mol)$
$\to V_{H_2}=0,225.22,4=5,04(l)$

\(a,PTHH:Zn+2HCl\to ZnCl_2+H_2\\ b,n_{Zn}=\dfrac{13}{65}=0,2(mol)\)
Vì \(\dfrac{n_{Zn}}{1}>\dfrac{n_{HCl}}{2}\) nên Zn dư
\(\Rightarrow n_{Zn({\text{phản ứng})}}=\dfrac{1}{2}n_{HCl}=0,15(mol)\\ \Rightarrow n_{Zn(\text{dư})}=0,2-0,15=0,05(mol)\\ \Rightarrow m_{Zn(\text{dư})}=0,05.65=3,25(g)\\ c,n_{ZnCl_2}=n_{H_2}=\dfrac{1}{2}n_{HCl}=0,15(mol)\\ \Rightarrow a=m_{ZnCl_2}=0,15.136=20,4(g)\\ V=V_{H_2}=0,15.22,4=3,36(l)\)

nFe = 2.8/56 = 0.05 (mol)
nHCl = 14.6/36.5 = 0.4 (mol)
Fe + 2HCl => FeCl2 + H2
1.........2
0.05......0.4
LTL : 0.05/1 < 0.4/2
=> HCl dư
mHCl (dư) = ( 0.4 - 0.1 ) * 36.5 = 10.95 (g)
VH2 = 0.05*22.4 = 1.12 (l)
nHCl (dư) = 0.4 - 0.1 = 0.3 (mol)
mFe cần thêm = 0.3/2 * 56 = 8.4 (g)

Phương trình hóa học: 2NaOH + H 2 S O 4 → N a 2 S O 4 + 2 H 2 O

a, Magnesium + Sulfuric acid → Magnesium sulfate + Hydrogen
b, BTKL: mMg + mH2SO4 = mMgSO4 + mH2
c, Từ b, có: mH2SO4 = mMgSO4 + mH2 - mMg = 27,2 + 0,4 - 13 = 14,6 (g)

uiii em ơi, 2p mà viết và chụp xong luôn rồi à, nhanh thật, bái phục

Bn phải ghi rõ là oxit nào nha.
a. PT: Fe2O3 + 3CO ---> 2Fe + 3CO2.
b. Ta có: \(n_{Fe_2O_3}=\dfrac{32}{160}=0,2\left(mol\right)\)
nCO = \(\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Ta thấy: \(\dfrac{0,2}{1}>\dfrac{0,3}{3}\)
Vậy Fe dư.
c. Theo PT: nFe = 2.nCO = 2 . 0,3 = 0,6(mol)
=> mFe = 0,6 . 56 = 33,6(g)
Theo PT: \(n_{CO_2}=n_{CO}=0,3\left(mol\right)\)
=> \(m_{CO_2}=0,3.44=13,2\left(g\right)\)
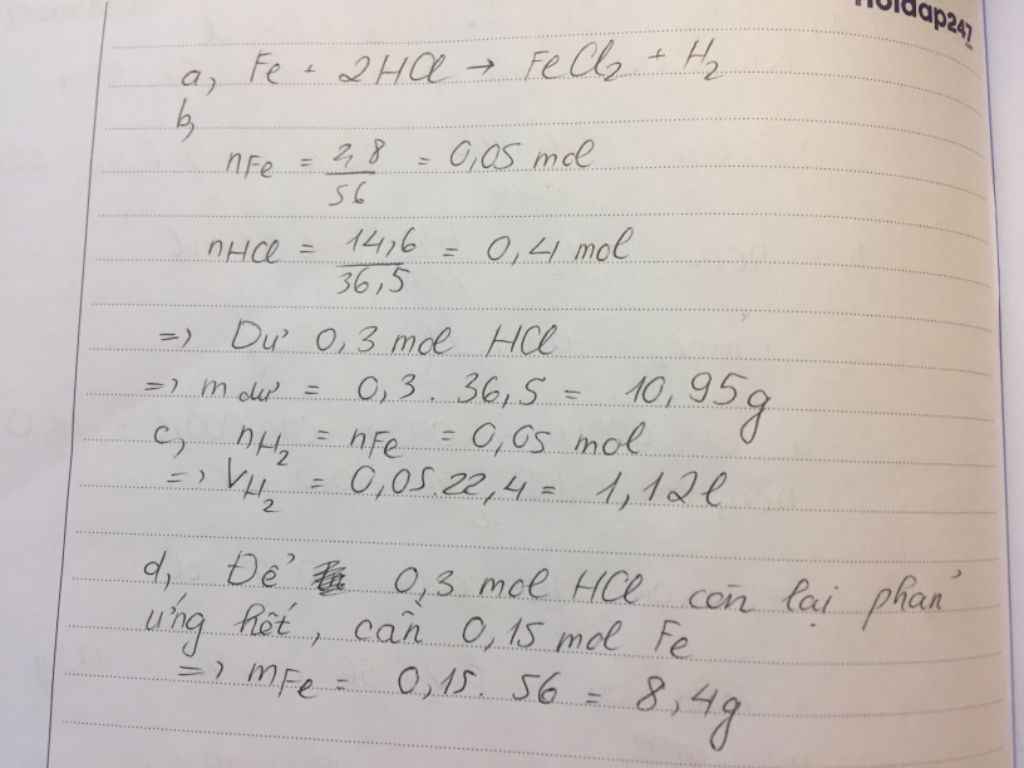
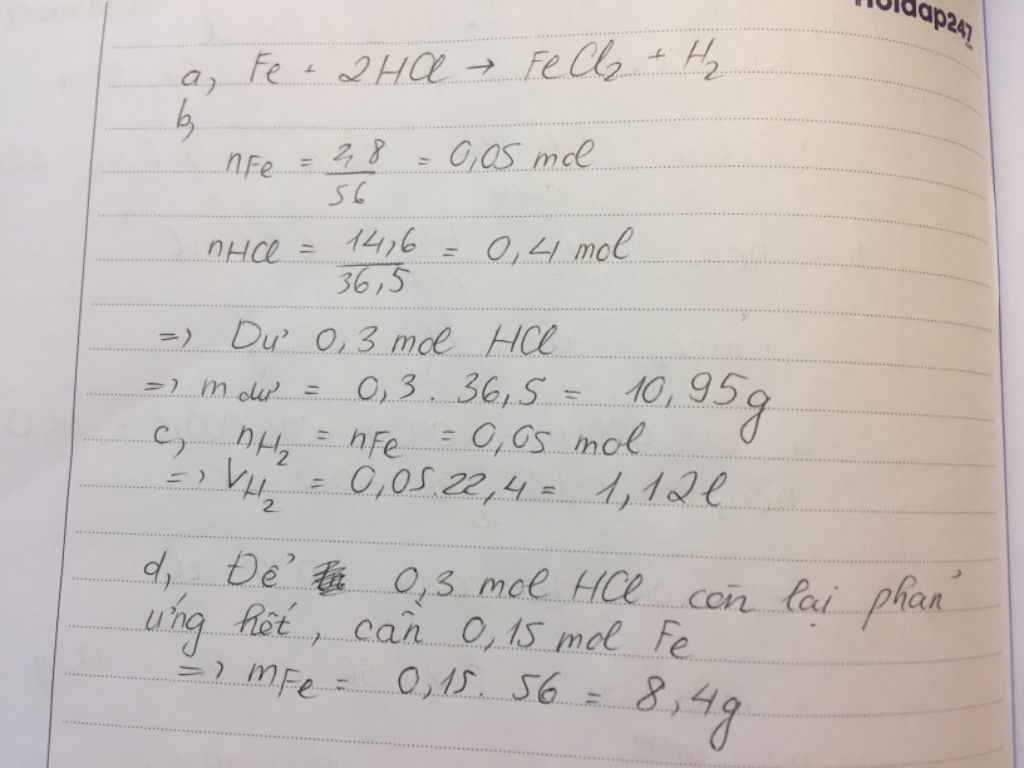
Giúp với ạ
KCl + H2SO4 -> KHSO4 + HCl
MnO2 + 4KCl + 2H2SO4 -> MnSO4 + 2K2SO4 + Cl2 + 2H2O
2KCl + 2H2O -> (đpdd, cmn) KOH + Cl2 + H2
6KOH + 3Cl2 -> KClO3 + 5KCl + 3H2O