Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Theo giả thiết, suy ra trong Y có NO (khí không màu hóa nâu trong không khí).
Mặt khác, ![]() khí còn lại trong Y là H2. Vì đã có H2 sinh ra nên
NO
3
-
không còn trong dung dịch X.
khí còn lại trong Y là H2. Vì đã có H2 sinh ra nên
NO
3
-
không còn trong dung dịch X.
Theo giả thiết, bảo toàn nguyên tố N, bảo toàn electron, ta có :


Khí không màu hóa nâu trong kk là NO. Vì tỷ khối của 2 khí là 24,4 nên có 1 khí là H2
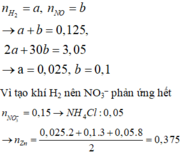
⇒ mMuối = mZnCl2 + mNH4Cl + mNaCl + mKCl = 64,05 gam
Đáp án C

Đáp án C
Khí không màu hóa nâu trong kk là NO.
Vì tỷ khối của 2 khí là 24,4 nên có 1 khí là H2
![]()
![]()
Vì tạo khí H2 nên NO3– phản ứng hết
![]()
![]()
⇒ mMuối = mZnCl2 + mNH4Cl + mNaCl + mKCl = 64,05 gam

Đáp án B
NO3- phản ứng hết
Giả sử nNH4+ = x mol
+ BTNT N: nNH4++nNO = nNaNO3+nKNO3 => x+0,1 = 0,05+0,1 => x=0,05 mol
+ BT electron => nZn = (3nNO+2nH2+8nNH4+)/2=(3.0,1+2.0,025+8.0,05)/2=0,375 mol
+ BTĐT: nCl-=(2nZn2+ + nNa+ + nK+ + nNH4+) = (2.0,375+0,05+0,1+0,05)=0,95 mol
Dung dịch X gồm:
0,375 mol Zn2+
0,05 mol Na+
0,1 mol K+
0,05 mol NH4+
0,95 mol Cl-
=>m=0,375.65+0,05.23+0,1.39+0,05.18+0,95.35,5=64,05 g

Vì ta có thể tính được ngay số mol của N2 và H2 và đây cũng là dự kiện mấu chốt để tìm m với dạng toàn này nên đầu tiên ta tìm số mol của N2 và H2 bằng cách: đặt nN2 và H2 lần lượt là x, y. Ta được: x + y = 0,025
tỉ khối so với H2: 28x + 2y/ 2(x + y) = 11,4 (với x + y = 0,025)
=> x = 0,02; y = 0,005
Sử dụng bảo toàn electron: số mol electron nhường = số mol electron nhận thì: 2nMg > ***N2 + 2nH2 nên phản ứng có tạo NH4Cl
quá trình oxi hóa: Mg - 2e -----> Mg2+
quá trình khử: 2NO3- -10e ----> N2 (N(+5) -5e ----> N(0))
NO3- -8e ------> NH4+ (n(+5) - 8e ---> N(-3))
2H+ -2e ---> H2
Vậy 2.0,124 = 0,025.10 + 0,005.2 + 8nNH4+ => nNH4+ = 0,01
m = mMgCl2 + mNH4Cl = 0,145.95 + 0,01.53,5 = 14,31 gam
mol Mg = 0,145 ==> mol e nhường = 0,29 ==> mol NH4+ = 0,01
2 NO3- + 10e + 12 H+ ----> N2 + 6 H2O
0,04-------0,2------0,24-------0,02
NO3- + 8e + 10 H+ ----> NH4+ + 3 H2O
0,01----0,08------0,1-------0,01
2 H+ + 2e ----> H2
0,01----0,01------0,005
mol HCl = mol Cl- = mol H+ = 0,35
mol KNO3 = mol K+ = mol NO3- = 0,05
muối gồm : Mg2+ = 0,145 mol, NH4+ = 0,01 mol, K+ = 0,05 và mol Cl- = 0,35
khối lượng muối = 24*0,145 + 39*0,05 + 35,5*0,35 = 18,035

Tính được nZn = 0,375 mol; nNH4+ = 0,05 mol
Muối có ZnCl2 0,375 mol
NH4Cl 0,05 mol
NaCl 0,05 mol và KCl 0,1 mol
suy ra m = 64,05 g


Đáp án B
Hai khí thu được không màu, có một khí hóa nâu trong không khí là NO.
M Y = 2 . 12 , 2 = 24 , 4 < M NO => Chứng tỏ khí còn lại trong Y có PTK nhỏ hơn 24,4 => Đó là H2.
Đặt a, b lần lượt là số mol NO và H2
Vì phản ứng có tạo khí H2 nên NO 3 - đã phản ứng hết mà n NO < n NO 3 - => có muối amoni tạo thành, n NH 4 + = 0 , 05 + 0 , 1 - 0 , 1 = 0 , 05 mol
⇒ n Cl - trong X = 2 . 0 , 375 + 0 , 05 + 0 , 1 + 0 , 05 = 0 , 95 mol ⇒ m = m cation + m animon = 65 . 0 , 375 + 23 . 0 , 05 + 39 . 0 , 1 + 18 . 0 , 05 + 35 , 5 . 0 , 95 = 64 , 05 g