Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi $n_{Fe} = a(mol) ; n_{Zn} = b(mol) \Rightarrow 56a + 65b = 1,77(1)$
$n_{NO_2} = \dfrac{1,792}{22,4} = 0,08(mol)$
Bảo toàn electron :
$3n_{Fe} + 2n_{Zn} = n_{NO_2} \Rightarrow 3a + 2b = 0,08(2)$
Từ (1)(2) suy ra: a = 0,02 ; b = 0,01
$\%m_{Fe} = \dfrac{0,02.56}{1,77}.100\% = 63,3\%$
$\%m_{Zn} =100\% - 63,3\% = 36,7\%$

a) \(n_{NO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Mg + 4HNO3 --> Mg(NO3)2 + 2NO2 + 2H2O
0,1<--0,4<------------------------0,2
=> mMg = 0,1.24 = 2,4 (g)
b) \(C_M=\dfrac{0,4}{0,2}=2M\)

\(10Al+36HNO_3\rightarrow10Al\left(NO_3\right)_3+3N_2+H_2O\)
\(n_{N_2}=\dfrac{6.72}{22.4}=0.3\left(mol\right)\)
Bảo toàn e :
\(n_{Al}=\dfrac{10\cdot n_{N_2}}{3}=\dfrac{10}{3}\cdot0.3=1\left(mol\right)\)
\(m_{Al}=1\cdot27=27\left(g\right)\)
\(n_{HNO_3}=12n_{N_2}=12\cdot0.3=3.6\left(mol\right)\)
\(C_{M_{HNO_3}}=\dfrac{3.6}{0.1}=36\left(M\right)\)

Gọi n, m là hóa trị của R khi tác dụng HNO3 và H2SO4 loãng ( 1≤ m≤ n≤ 3)
Chọn nR= 1 mol
2R + mH2SO4 →R2(SO4)m + mH2↑
1 → 0,5 0,5m
R + 2nHNO3 →R(NO3)n + nNO2 + nH2O
1 1 n
Ta có: n=3.0,5m n=1,5m m=2, n=3 là phù hợp.
Ta có: (R + 96)=(R + 186). 0,6281 R=56 R là Fe.
Đáp án B


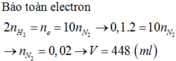
a) 3Zn + 8HNO3 --> 3Zn(NO3)2 + 2NO + 4H2O
b) \(n_{HNO_3}=0,2.4=0,8\left(mol\right)\)
PTHH: 3Zn + 8HNO3 --> 3Zn(NO3)2 + 2NO + 4H2O
0,3<----0,8----------------------->0,2
=> mZn = 0,3.65 = 19,5 (g)
c) VNO = 0,2.22,4 = 4,48(l)