Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(2A\left(x\right)\rightarrow B\left(0,5x\right)+2C\left(x\right)+4D\left(2x\right)\)
Gọi số mol của A là x ta có
\(M_A=\frac{m}{x}\Rightarrow m=M_Ax\)
Theo định luật bảo toàn khối lượng ta có:
\(m=0,5xB+xD+2xE\)
Khối lượng mol trung bình của hỗn hợp khí là: 22,86g/mol nên ta có
\(\frac{0,5xB+xD+2xE}{0,5x+x+2x}=22,86\)
\(\Leftrightarrow\frac{m}{0,5x+x+2x}=22,86\)
\(\Leftrightarrow\frac{M_Ax}{0,5x+x+2x}=22,86\)
\(\Leftrightarrow\frac{M_A}{3,5}=22,86\Leftrightarrow M_A=80\)
Vậy khối lượng mol của A là: 80 g/mol

Đáp án B
Cu + 2 Ag + → Cu 2 + + 2 Ag
mchất rắn tăng = nCu.(2.108-64)=152.nCu
=> nCu phản ứng = 0,01 mol = n Cu 2 +
=> n Ag + phản ứng = 0 , 02 ( mol )
A gồm 0,01 mol Cu2+ và Ag+ dư.
B chỉ chứa 1 muối duy nhất là muối Pb2+
Tương tự:
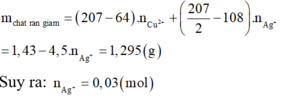
Vậy tổng số mol Ag+ là 0,05 (mol)

Cho Y chứa 3 kim loại, tác dụng với dung dịch HCl dư thu được 0,035 mol khí H2 → Y chứa Fe dư
Vậy Y chứa Cu : x mol , Ag: x mol và Fe dư : 0,035 mol
⇒ Fe pư : 0,05 - 0,035 = 0,015 mol
Bảo toàn electron → 2nCu(NO3)2 + nAgNO3 = 2nFe + 3nAl
⇒ 2x + x = 2. 0,015 + 0,03. 3 → x = 0,04 mol
⇒ CMCu(NO3)2 = CMAgNO3 = 0,04 : 0,1 = 0,4M
Đáp án B

Y + HCl tạo 0,035 mol H2
![]() nFe dư = 0,035
nFe dư = 0,035
![]() nFe phản ứng với muối = 0,05 – 0,035 = 0,015
nFe phản ứng với muối = 0,05 – 0,035 = 0,015
Bảo toàn ne
![]() nAg+ + 2nCu2+ = 3nAl + 2nFe = 0,12
nAg+ + 2nCu2+ = 3nAl + 2nFe = 0,12
Do Ag+ và Cu2+ cùng nồng độ
![]() nAg+ = nCu2+ = 0,04
nAg+ = nCu2+ = 0,04
![]() [Ag+] = [Cu2+] = 0,04/0,1 = 0,4M
[Ag+] = [Cu2+] = 0,04/0,1 = 0,4M
![]() Chọn B.
Chọn B.

Đáp án A
Gọi x = nN2, y = nNO2
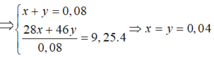
Bảo toàn nguyên tố N => nHNO3 = nNO3- tạo muối + 2nN2 + nNO2
nHNO3 = (10nN2 + nNO2) + 2nN2 + nNO2 = 0,56=> CM của HNO3 = 0,56/2 = 0,28M



Chọn C
Tốc độ trung bình của phản ứng tính theo chất X là