Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{O_2}=\dfrac{2,479}{24,79}=0,1(mol)\\ \Rightarrow A\)

a, PT: \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
b, Ta có: \(n_{KMnO_4}=\dfrac{3,16}{158}=0,02\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{1}{2}n_{KMnO_4}=0,01\left(mol\right)\)
\(\Rightarrow m_{O_2}=0,01.32=0,32\left(g\right)\)
c, \(V_{O_2}=0,01.24,79=0,2479\left(l\right)\)


\(n_{KMnO_4\left(lt\right)}=\dfrac{31.6}{158}\cdot80\%=0.16\left(mol\right)\)
\(2KMnO_4\underrightarrow{^{^{t^0}}}K_2MnO_4+MnO_2+O_2\)
\(0.16.............................................0.08\)
\(V_{O_2}=0.08\cdot22.4=1.792\left(l\right)\)

a) Phương trình phản ứng:
2CO + O2 → 2CO2
b) Theo phương trình 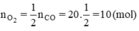
c) Hoàn chỉnh bảng
Thời điểm t1 nCO còn 15mol ⇒ nCO đã phản ứng = 20 - 15= 5mol
Theo pt nCO2 = nCO(pư) = 5 mol
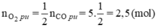 ⇒ nO2 còn lại = 10 - 2,5 = 7,5 mol
⇒ nO2 còn lại = 10 - 2,5 = 7,5 mol
Tương tự tính thời điểm t2 và thời điểm t3 ta được số liệu sau:
| Số mol | |||
| Các thời điểm | Các chất phản ứng | Sản phẩm | |
| CO | O2 | CO2 | |
| Thời điểm ban đầu t0 | 20 | 10 | 0 |
| Thời điểm t1 | 15 | 7,5 | 5 |
| Thời điểm t2 | 3 | 1,5 | 17 |
| Thời điểm kết thúc t3 | 0 | 0 | 20 |

a. \(n_{KMnO_4}=\dfrac{118.5}{158}=0,75\left(mol\right)\)
PTHH : 2KMnO4 -----to----> K2MnO4 + MnO2 + O2
0,75 0,375
Phản ứng trên là phản ứng phân hủy . Vì phản ứng phân hủy là một phản ứng hóa học mà trong đó một chất tham gia có thể tạo thành hai hay nhiều chất mới.
b. \(V_{O_2}=0,375.22,4=8,4\left(l\right)\)
c. \(V_{kk}=8,4.5=42\left(l\right)\)
a) 2KMn04 --> K2MnO4 + MnO2 + O2↑
PƯ này thuộc loại PƯ phân hủy
b) Có nKMnO4 = \(\dfrac{118.5}{39+55+16.4}\)=\(\dfrac{3}{4}\)=0,75
=> nO2 = 0,75x \(\dfrac{1}{2}\)=0,375
=> V của O2 là: 0,375 x 22,4=8,4(l)
c) Thể tích của ko khí là: 1/5 x 8,4=1,68(l)

\(n_{KMnO_4}=\dfrac{118,5}{158}=0,75\left(mol\right)\\
pthh:2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
0,75 0,375
=> \(V_{O_2}=0,375.22,4=8,4\left(l\right)\\
V_{kk}=8,4.5=42\left(l\right)\)
Theo PT: \(n_{O_2}=\dfrac{1}{2}n_{KMnO_4}=1\left(mol\right)\)
→ Đáp án: D