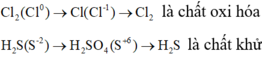
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

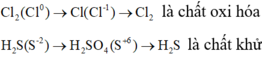

D đúng.
Cl20 + 2e → 2Cl- ⇒ Cl2 là chất oxi hóa
S2- → S+6 + 8e ⇒ S là chất khử

Câu18. Cho phản ứng H2S +Cl2+H2O➜HCl + H2SO4.
A.H2S là chất oxi hóa, H2O là chất khử.
B. Cl2là chất oxi hóa. H2S là chất khử.
C. Cl2là chất khử , H2S là chất oxi hóa.
D. H2S là chất khử,H2O là chất oxi hóa
giải thích : Chất oxi hóa là chất có số oxi hóa giảm
Chất khử là chất có số oxi hóa tăng
Vậy H2S là chất khử, Cl2 là chất oxi hoá

1) 2NH3 + 3Cl2 --> N2 + 6HCl
Chất oxh: Cl2, chất khử: NH3
| QT oxh | 2N-3 - 6e --> N20 | x1 |
| QT khử | Cl20 + 2e --> 2Cl-1 | x3 |
2) 4Zn + 5H2SO4 --> 4ZnSO4 + H2S + 4H2O
Chất oxh: H2SO4
Chất khử: Zn
Chất môi trường: H2SO4
| QT oxh | Zn0 - 2e --> Zn+2 | x4 |
| QT khử | S+6 + 8e --> S-2 | x1 |

Bạn tham khảo
Bài 1: Cân bằng phản ứng oxi hóa – khử ( bằng phương pháp thăng bằng electron) sau và cho biết chất khử, chất oxi hóa, quá trình khử, quá trình oxi hóa ở mỗi p

Câu 2: Một nguyên tố R tạo hợp chất khí với hiđro có công thức RH3. Nguy
Câu 3:
\(a,\) Đặt \(\begin{cases} n_{Fe}=x(mol)\\ n_{Al}=y(mol) \end{cases} \Rightarrow 56x+27y=22(1)\)
\(n_{H_2}=\dfrac{17,92}{22,4}=0,8(mol)\\ PTHH:Fe+2HCl\to FeCl_2+H_2\\ 2Al+6HCl\to 2AlCl_3+3H_2\\ \Rightarrow x+1,5y=0,8(2)\\ (1)(2)\Rightarrow \begin{cases} x=0,2(mol)\\ y=0,4(mol) \end{cases} \Rightarrow \begin{cases} \%_{Fe}=\dfrac{0,2.56}{22}.100\%=50,91\%\\ \%_{Al}=100\%-50,91\%=49,09\% \end{cases}\)
\(b,\Sigma n_{HCl}=2n_{Fe}+3n_{Al}=1,6(mol)\\ \Rightarrow m_{dd_{HCl}}=\dfrac{1,6.36,5}{3,7\%}=1578,38(g)\)

NO2 đóng vai trò vừa là chất oxi hóa vừa là chất khử: C đúng