Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Coi $m_{dd\ HCl} = 100(gam) \Rightarrow n_{HCl} = \dfrac{100.7,3\%}{36,5} = 0,2(mol)$
Gọi $n_{BaCO_3} = a(mol)$
BaCO3 + 2HCl → BaCl2 + CO2 + H2O
a..................2a............a..............a........................(mol)
Sau phản ứng :
$m_{dd} = 197a + 100 - a.44 = 153a + 100(gam)$
$n_{HCl\ dư} = 0,2 - 2a(mol)$
Suy ra :
$C\%_{HCl} = \dfrac{(0,2-2a).36,5}{153a + 100}.100\% = 2,28\%$
$\Rightarrow a = 0,066$
$C\%_{BaCl_2} = \dfrac{0,066.208}{0,066.153 + 100}.100\% = 12,47\%$

\(GS:m_{dd_{HCl}}=100\left(g\right)\)
\(m_{HCl}=100\cdot7.3\%=7.3\left(g\right)\)
\(n_{BaCO_3}=a\left(mol\right)\)
\(BaCO_3+2HCl\rightarrow BaCl_2+CO_2+H_2O\)
\(a..........2a.........a......a\)
\(m_{\text{dung dịch sau phản ứng}}=197a+100-44a=153a+100\left(g\right)\)\(\)
\(m_{HCl}=7.3-73a\left(g\right)\)
\(C\%_{HCl\left(dư\right)}=\dfrac{7.3-73a}{153a+100}\cdot100\%=2.28\%\)
\(\Rightarrow a=0.065\)
\(C\%_{BaCl_2}=\dfrac{0.065\cdot208}{153\cdot0.065+100}\cdot100\%=12.3\%\)

Để giải bài toán này, ta cần biết phương trình phản ứng giữa Fe và HCl: Fe + 2HCl -> FeCl2 + H2 a. Để xác định nồng độ dung dịch HCl cần dùng, ta cần tính số mol của Fe. Đầu tiên, ta cần chuyển khối lượng Fe thành số mol bằng cách sử dụng khối lượng mol của Fe (56g/mol): Số mol Fe = khối lượng Fe / khối lượng mol Fe = 5,6g / 56g/mol = 0,1 mol Vì theo phương trình phản ứng, 1 mol Fe tương ứng với 2 mol HCl, nên số mol HCl cần dùng là gấp đôi số mol Fe: Số mol HCl = 2 x số mol Fe = 2 x 0,1 mol = 0,2 mol Để tính nồng độ dung dịch HCl, ta chia số mol HCl cho thể tích dung dịch HCl: Nồng độ HCl = số mol HCl / thể tích dung dịch HCl = 0,2 mol / 0,1 L = 2 mol/L Vậy, nồng độ dung dịch HCl cần dùng là 2 mol/L. b. Để xác định khối lượng muối thu được sau phản ứng, ta cần tính số mol muối FeCl2. Theo phương trình phản ứng, 1 mol Fe tương ứng với 1 mol FeCl2, nên số mol muối FeCl2 cũng là 0,1 mol. Khối lượng muối FeCl2 = số mol muối FeCl2 x khối lượng mol muối FeCl2 = 0,1 mol x (56g/mol + 2 x 35,5g/mol) = 0,1 mol x 127g/mol = 12,7g Vậy, khối lượng muối thu được sau phản ứng là 12,7g. c. Để xác định thể tích Hidro thu được sau phản ứng, ta cần tính số mol H2. Theo phương trình phản ứng, 1 mol Fe tương ứng với 1 mol H2, nên số mol H2 cũng là 0,1 mol. Thể tích H2 = số mol H2 x thể tích mol của H2 = 0,1 mol x 22,4 L/mol = 2,24 L Vậy, thể tích Hidro thu được sau phản ứng là 2,24 L.

– Số mol KMnO4 = 0,2 (mol); số mol KOH = 2 (mol)
– Phương trình phản ứng:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
0,2 0,5
* Ở điều kiện nhiệt độ thường:
Cl2 + 2KOH → KCl + KClO + H2O
0,5 1,0 0,5 0,5
– Dư 1,0 mol KOH
CM (KCl) = CM (KClO) = 0,5 (M); CM (KOH dư) = 1 (M)
* Ở điều kiện đun nóng trên 700C:
3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O
0,5 1,0 5/6 1/6
– Dư 1,0 mol KOH
CM (KCl) = 5/6 (M); CM (KClO3) = 1/6 (M); CM (KOH dư) = 1 (M).

1. Cho 200g dung dịch NaOH 20% tác dụng vừa hết với 100g dung dịch HCl. Tính:
a) Nồng độ muối thu được sau phản ứng?
b) Tính nồng độ axit HCl. Biết phản ứng xảy ra hoàn toàn?
---
a) mNaOH=20%.200=40(g) -> nNaOH=40/40=0,1(mol)
PTHH: NaOH + HCl -> NaCl + H2O
Ta có: nNaCl=nHCl=nNaOH=1(mol)
=> mNaCl=1.58,5=58,5(g)
mddNaCl=mddNaOH + mddHCl= 200+100=300(g)
=>C%ddNaCl= (58,5/300).100=19,5%
b) mHCl=0,1. 36,5=36,5(g)
=> C%ddHCl=(36,5/100).100=36,5%
2. Hòa tan hoàn toàn 11,2g sắt cần vừa đủ V(l) dung dịch HCl 0,2M sau phản ứng thu được dung dịch A và X (lít) H2(đktc).
a) Tìm V?
b) Tìm X?
c) Tính CM của muối thu được trong dung dịch A?
---
a) nFe=0,2(mol)
PTHH: Fe + 2 HCl -> FeCl2 + H2
0,2_____0,4______0,2___0,2(mol)
a) V=VddHCl= nHCl/CMddHCl= 0,4/0,2=2(l)
b) V(H2,đktc)=0,2.22,4=4,48(l)
c) Vddmuoi=VddHCl=2(l)
CMddFeCl2= (0,2/2)=0,1(M)
Chúc em học tốt!

Sau phản ứng, thu được hỗn hợp kim loại, suy ra kẽm dư.
$n_{CuSO_4} = \dfrac{80.30\%}{160} = 0,15(mol)$
$Zn + CuSO_4 \to ZnSO_4 + Cu$
$n_{Zn\ pư} = n_{CuSO_4} = 0,15(mol)$
$\Rightarrow m_{Zn\ pư} = 0,15.65 = 9,75(gam)$
Sau phản ứng, $m_{dd} = 9,75 + 80 - 0,15.64 = 80,15(gam)$
$C\%_{ZnSO_4} = \dfrac{0,15.161}{80,15}.100\% = 30,13\%$

a) Vì: mA < 400 (g) nên phải có khí thoát ra → muối có dạng MHSO4 và khí là: CO2
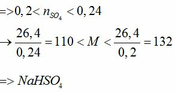
b)
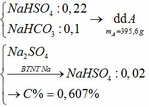
c) Tác dụng được với: MgCO3, Ba(HSO3)2, Al2O3, Fe(OH)2, Fe, Fe(NO3)2
Pt: 2NaHSO4 + MgCO3 → Na2SO4 + MgSO4 + CO2↑ + H2O
2NaHSO4 + Ba(HSO3)2 → BaSO4 + Na2SO4 + SO2↑ + 2H2O
6NaHSO4 + Al2O3 → 3Na2SO4 + Al2(SO4)3 + 3H2O
2NaHSO4 + Fe(OH)2 → Na2SO4 + FeSO4 + 2H2O
2NaHSO4 + Fe → Na2SO4 + FeSO4 + H2↑
12NaHSO4 + 9Fe(NO3)2 → 5Fe(NO3)3 + 2Fe2(SO4)3 + 6Na2SO4 + 3NO↑ + 6H2O
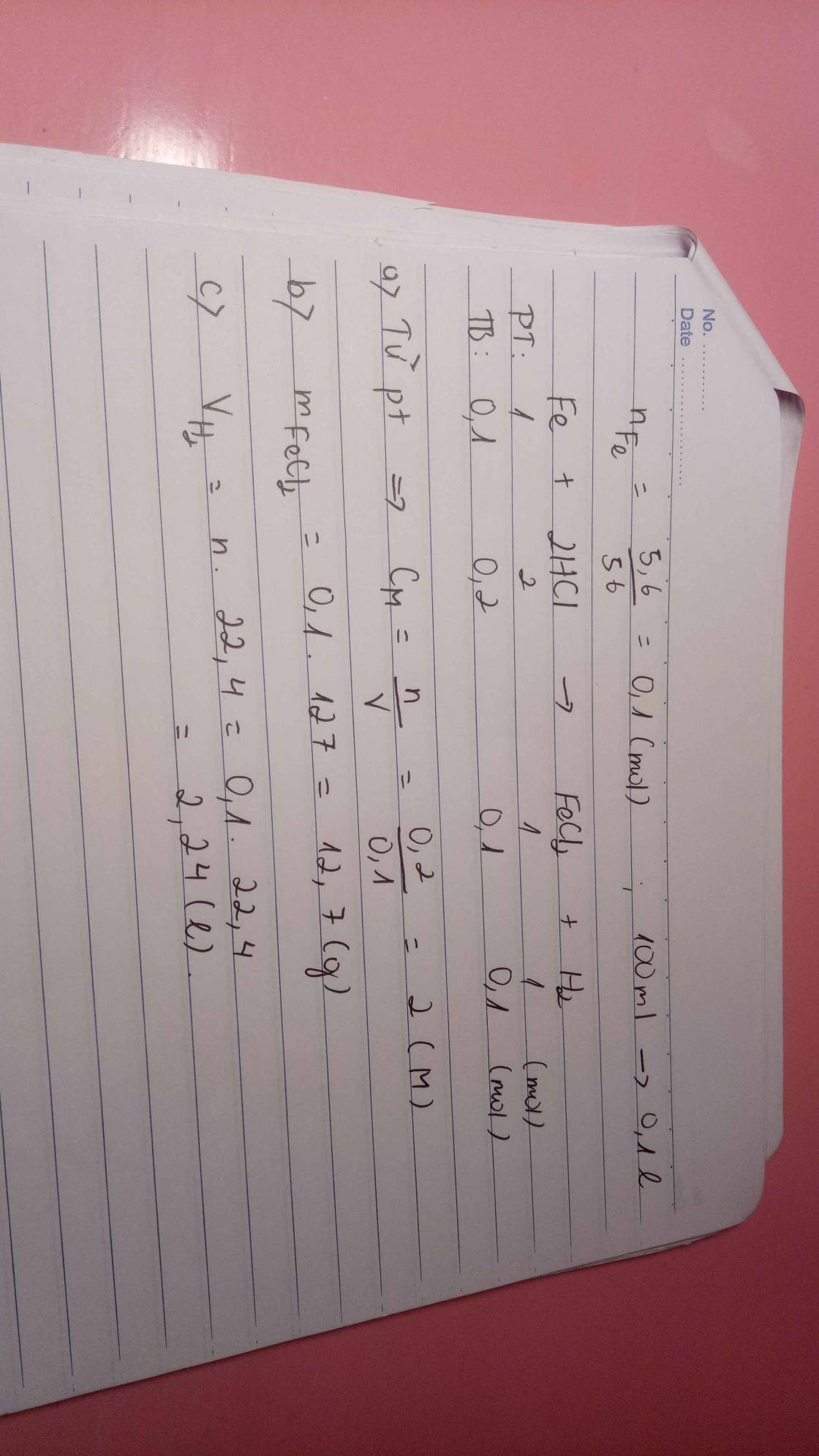
Giả sử \(m_{dd_{HCl29,2\%}}=100\left(g\right)\)
\(\Rightarrow n_{HCl}=\frac{29,2}{36,5}=0,8\left(mol\right)\)
\(CaCO_3+2HCl\rightarrow CaCl_2+H_2O+CO_2\)
x_______2x__________x_____________x
\(m_{dd_{spu}}=100x+100-44x=56x+100\)
\(m_{HCl_{dư}}=36,5\left(0,8-2x\right)=29,2-73x\)
\(\Rightarrow\frac{29,2-73x}{56x+100}=0,2074\)
\(\Leftrightarrow29,2-73x=0,2074\left(56x+100\right)\)
\(\Leftrightarrow x=0,1\)
X có 0,6mol HCl ;0,1mol CaCl2
\(m_{ddX}=56.0,1+100=105,6\left(g\right)\)
\(BaCO_3+2HCl\rightarrow BaCl_2+CO_2+H_2O\)
y________2y______y_________y______________
\(m_{dd_{spu}}=197y+105,6+44y=153y+105,6\left(g\right)\)
\(\Rightarrow m_{HCL_{Dư}}=36,5.\left(0,06-2y\right)=21,9-73y\left(g\right)\)
\(\Rightarrow\frac{21,9-73y}{153y+105,6}=0,0852\)
\(\Leftrightarrow21,9-73y=0,0852.\left(153y+105,6\right)\)
\(\Leftrightarrow y=0,15\)
Y có 0,15mol BaCl2 ; 0,1mol CaCl2
\(m_{dd_Y}=153.0,15+105,6=128,55\left(g\right)\)
\(C\%_{CaCl2}=\frac{0,1.111.100}{128,55}=8,63\%\)
\(C\%_{BaCl2}=\frac{0,15.208.100}{128,55}=24,27\%\)