Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Do X tác dụng được với HCl ⇒ Al dư. Bảo toàn electron: nAl dư = 0,01 mol.
Bảo toàn gốc NO3: nNO3–/dung dịch sau = 0,09 mol. Bảo toàn điện tích: nAl3+ = 0,03 mol.
► Bảo toàn nguyên tố Al: m1 = 27 × (0,03 + 0,01) = 1,08(g). Lại có :
X gồm 0,03 mol Cu; 0,03 mol Ag và 0,01 mol Al dư ||⇒ m2 = 5,43(g)
⇒ chọn A

Chọn C
m2 gam X có thể phản ứng với HC1 tạo H2 Þ Có Al dư Þ nAl dư = 0,03/1,5 = 0,02
Vì AI dư Þ Toàn bộ Ag+ và Cu2+ đã bị khử hết về kim loại đơn chất
BTE Þ 3nAl phản ứng = 0,03x2 + 0,03 = 0,09 Þ nAl phản ứng = 0,03
Vậy m1 = (0,03 + 0,02)x27 = 1,35; m2 = 0,02x27 + 0,03x64 + 0,03x108 = 5,7

Chọn đáp án A
Chất rắn X có thể có Al, Cu và chắc chắn có Ag.
Cho X vào HCl mà tạo khí thì trong X chắc chắn có Al (do Cu và Ag không phản ứng với HCl).
Do có Al nên Cu2+ và Ag+ phản ứng hết.
Số mol Al ban đầu:
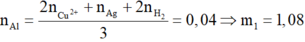
![]()
⇒ Chọn A

Đáp án D
Đọc quá trình và phân tích:
· 74,62 gam kết tủa rõ là 0,52 mol AgCl; mà nHCl = 0,5 mol ® nMCl = 0,02 mol (theo bảo toàn Cl).
· Đun nóng 20,29 gam X thu được 18,74 gam chất rắn, khối lượng giảm chỉ có thể do phản ứng nhiệt phân muối MHCO3 theo phương trình 2 M H C O 3 → M 2 C O 3 + C O 2 + H 2 O ® từ tỉ lệ phản ứng và tăng giám khối lượng có số mol muối MHCO3 là 2.(20,29-18,74)/(44+18)=0,05 mol
· 3,36 lít khí là CO2 ® Bảo toàn nguyên tố C có số mol M2CO3 ban đầu là 0,1 mol.
Vậy m X = 20 , 29 = 0 , 1 ( 2 M + 60 ) + 0 , 05 . ( M + 61 ) + 0 , 2 . ( M + 35 , 5 ) ® M = 39 là kim loại Kali (K).





Đáp án : D
nH2 = 0,025 mol > nHCl = 0,02 mol
=> Kim loại M có thể tan trong nước tạo bazo
=> nCl = 0,02 mol ; nOH = 0,03 mol
=> Kết tủa gồm : 0,02 mol AgCl ; 0,015 mol Ag2O
=> m1 = 6,35g