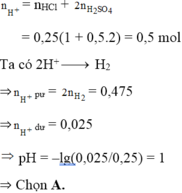Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Trong dung dịch axit, ta có :
n Cl - = n HCl = 0 , 3 mol
n SO 4 2 - = n H 2 SO 4 = 0 , 15 mol
Sơ đồ phản ứng :

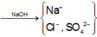
Cho NaOH vào X để thu được kết tủa lớn nhất thì dung dịch sau phản ứng chỉ còn các ion Na + , Cl - và SO 4 2 - .
Áp dụng bảo toàn điện tích trong dung dịch sau phản ứng và bảo toàn nguyên tố Na, ta có :
n NaOH = n Na + = n Cl - + 2 n SO 4 2 - = 0,6 mol
→ V dd NaOH 1 M = 0,6 lit = 600ml

Giải thích:
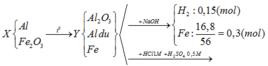
BT e: nAl dư = 2/3 nH2 = 2/3. 0,15 = 0,1 (mol)
BTNT: Fe => nFe2O3 = ½ nFe = 0,15 (mol)
Phản ứng xảy ra hoàn toàn, Al dư sau phản ứng ( vì Y + NaOH có khí H2 bay ra), do đó Fe2O3 phản ứng hết
Fe2O3 + 2Al Al2O3 + 2Fe
0,15 → 0,3
=> nAl ban đầu = 0,3 + 0,1 = 0,4 (mol)
nHCl = V (mol) ; nH2SO4 = 0,5V (mol)
Bảo toàn điện tích khi cho Y tác dụng với hh axit
=> 2nFe2+ + 3nAl3+ = nCl- + 2nSO42-
=> 2.0,3 + 3. 0,4 = V + 2. 0,5V
=> V = 0,9 (lít)
Đáp án B

Đáp án D
nOH-= 2nH2= 1,2 mol
ð nH+= 1,2 mol
Gọi thể tích dung dịch axit là x (lít)
nH+= 0,5.2x+x = 2x
ð 2x=1,2
ð x=0,6

Đáp án A
Phản ứng vừa đủ
=> Bảo toàn nguyên tố Hidro:
![]()
Bảo toàn khối lượng:
![]()