Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

khí X là H2 Y là NH3 => sp khử của HNO3 là NH4NO3
gọi số mol H2 là x => nNH3 ban đầu=nKOH=2nH2=2x
=> x+2x=0.015 =>x =0.005
tổng số mol NH3 =2x+0.224/22.4 =0.02
bảo toàn e : nKali=2nH2+8nNH4NO3( nNH4NO3=nNH3) => m

Quy hỗn hợp ban đầu chỉ có Fe và O
Bảo toàn nguyên tố với clo
DD sau phản ứng chỉ có FeCl2 0,4 mol
=> m Fe ban đầu=0,4*56+2,8=25,2g
n O=1/2 n H+ =0,4
=> m=m Fe + m O=25,2+0,4*16=31,6g

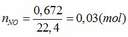
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O (1)
a → 4a → a → a (mol)
3Fe + 8HNO3 → 3Fe(NO3)2 + 2NO + 4H2O (2)
B → 8/3b → b →2/3b (mol)
TH1: xảy ra phản ứng (1) tạo muối Fe(NO3)3 => nFe(NO3)3 = nNO = 0,03 (mol)
=> mmuối = mFe(NO3)3 = 0,03. 242 = 7,26 (g) # 7,82 => loại
TH2: xảy ra phản ứng (2) tạo muối Fe(NO3)2 => nFe(NO3)2 = 3/2 nNO = 3/2 . 0,03 = 0,045 (mol)
=> mmuối = mFe(NO3)2 = 0,045. 180 = 8,1 (g) # 7,82 => loại
TH3: xảy ra cả (1) và (2) phản ứng tạo 2 muối.
Gọi số mol của Fe ở phản ứng (1) và (2) lần lượt là a và b (mol)
Đặt vào phương trình ta có:
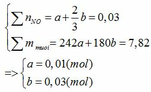
∑ nFe = 0,01 + 0,03 = 0,04 (mol) => mFe = 0,04.56 = 2,24 (g)
∑ nHNO3 pư = 4a + 8/3b = 4. 0,01 + 8/3. 0,03 = 0,12 (mol)
mHNO3 = 0,12.63 = 7,56 (g)
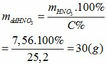
Khối lượng dd sau: mdd sau = mFe + mddHNO3 - mNO = 2,24 + 30 – 0,03.30 = 31,34 (g)
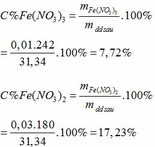

Gọi nFe3O4= a; nCu= b→ 232a+ 64b= 36 (1)
Fe3O4+ 8HCl→ 2FeCl3+ FeCl2+ H42O.
2FeCl3+ Cu→ 2FeCl2+ CuCl2.
Theo giả thiết: nCu dư= 6,4/64= 0,1(mol).
→ nCu PƯ= b–0,1
Từ 2 PT: nFe3O4= nFeCl3/2= nCu(PƯ)
↔ a= b–0,1 (2)
Giải hệ PT (1) và (2) ↔ a=0,1; b=0,2
Vậy %mFe3O4= 232.0,1.100/36 =64,44 (%)
Vì còn dư kim loại là Cu ==> thu được muối Fe2+
Gọi a, b là số mol Fe và Cu phản ứng , và x là số mol Cu dư
số mol HNO3 = 0,2*2 = 0,4
Fe - 2e --> Fe+2
a-----2a
Cu -2e --> Cu+2
b----2b
4H+ + NO3- + 3e --> NO + 2H2O
0,4--------------0,3
kim loại dư là Cu và số mol H2SO4 = 0,03333*2 ==> mol H+ = 0,1333
3Cu + 8H+ + NO3- --> 3Cu+2 + NO + H2O
0,05---0,133
Ta có : khối lượng kim loại phản ứng: 56a + 64b = 12 - 64*0,05 = 8,8
Bảo toàn số mol e : 2a+ 2b = 0,3
=> a = 0,1 và b = 0,05
===> = 5,6 g ==> câu A

PTHH: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
a) Ta có: \(n_{C_2H_4}=\dfrac{9,1}{28}=0,325\left(mol\right)=n_{Br_2}\) \(\Rightarrow V_{Br_2}=\dfrac{0,325}{2}=0,1625\left(l\right)=162,5\left(ml\right)\)
b) Ta có: \(\left\{{}\begin{matrix}n_{C_2H_4}=0,325\left(mol\right)\\n_{CH_4}=\dfrac{13,44}{22,4}-0,325=0,275\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{hh}=9,1+0,275\cdot16=13,5\left(g\right)\)
c) PTHH: \(CH_4+2O_2 \underrightarrow{t^o} CO_2+2H_2O\)
\(C_2H_4+3O_2 \underrightarrow{t^o} 2CO_2+ 2H_2O\)
Theo các PTHH: \(\Sigma n_{O_2}=2n_{CH_4}+3n_{C_2H_4}=1,525\left(mol\right)\)
\(\Rightarrow V_{O_2}=1,525\cdot22,4=34,16\left(l\right)\)

Ta có: \(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
____0,4_____0,8____0,4_____0,4 (mol)
a, \(m_{HCl}=0,8.36,5=29,2\left(g\right)\)
b, \(m_{FeCl_2}=0,4.127=50,8\left(g\right)\)
c, \(m_{H_2}=0,4.2=0,8\left(g\right)\)
d, \(m_{ddHCl}=\dfrac{29,2}{14,6\%}=200\left(g\right)\)
m dd sau pư = 22,4 + 200 - 0,8 = 221,6 (g)
e, \(C\%_{FeCl_2}=\dfrac{50,8}{221,6}.100\%\approx22,92\%\)

\(n_{CaO}=n_{CaCO_3}=a\\ 56a+100a=31,2\\ a=0,2=n_{CO_2}\\ n_{KOH}=0,4\cdot0,75=0,3\\ n_{OH^-}:n_{CO_2}=0,3:0,2=1,5\Rightarrow K_2CO_3\left(x\right);KHCO_3\left(y\right)\\ 2x+y=0,3\\ x+y=0,2\\ x=0,1;y=0,1\\ m=0,1\left(106+100\right)=20,6g\)
Fe + 4HNO3 →Fe(NO3)3 + NO + 2H2O
\(n_{HNO_3}=0,4.2=0,8\left(mol\right)\)
TH1 : 2 chất đều phản ứng hết
\(n_{Fe}=\dfrac{0,8}{4}=0,2\left(mol\right)\)
=> m Fe=11,2g
\(n_{Fe\left(NO_3\right)_3}=\dfrac{0,8}{4}=0,2\left(mol\right)\)
=> \(m_{Fe\left(NO_3\right)_3}=0,2.242=48,4\left(g\right)\)
Theo đề m gam Fe ------> 3m gam muối
Mà \(\dfrac{48,4}{11,2}=4,32\)
Vậy TH này loại
TH2: HNO3 dư
Fe + 4HNO3 →Fe(NO3)3 + NO + 2H2O
\(\dfrac{m}{56}\)--->\(\dfrac{m}{14}\)---->\(\dfrac{m}{56}\)
=> \(\dfrac{m}{56}=\dfrac{3m}{56+62.3}\)
=> m=0 (loại)
TH3: Fe dư
Fe + 4HNO3 → Fe(NO3)3 + NO↑ + 2H2O
0,2<--0,8---------->0,2
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
\(\dfrac{m}{56}-0,2\)---------------------------------------->\(3\left(\dfrac{m}{56}-0,2\right)\)
=> \(n_{Fe\left(NO_3\right)_3}=3\left(\dfrac{m}{56}-0,2\right)=\dfrac{3m}{56+62.3}\)
=>m=\(\dfrac{6776}{465}\left(g\right)\approx14,572\left(g\right)\)