Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
b, \(n_{Fe}=\dfrac{16,8}{56}=0,3\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{2}{3}n_{Fe}=0,2\left(mol\right)\Rightarrow V_{O_2}=0,2.22,4=4,48\left(l\right)\)
\(n_{Fe_3O_4}=\dfrac{1}{3}n_{Fe}=0,1\left(mol\right)\Rightarrow m_{Fe_3O_4}=0,1.232=23,2\left(g\right)\)
c, \(n_{CuO}=\dfrac{16}{80}=0,2\left(mol\right)\)
PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Xét tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{0,3}{1}\), ta được H2 dư.
Theo PT: \(n_{Cu}=n_{CuO}=0,2\left(mol\right)\Rightarrow m_{Cu}=0,2.64=12,8\left(g\right)\)

a) Phản ứng
CuO + H 2 → t o Cu + H 2 O (1)
(mol) 0,3 0,3 ← 0,3
b) Ta có: n Cu = 19,2/64 = 0,3 (mol)
Từ (1) → n Cu = 0,3 (mol) → m CuO = 0,3 x 80 = 24 (gam)
Và n H 2 = 0,3 (mol) → V H 2 =0,3 x 22,4 = 6,72 (lít)

a) nCu=0,2(mol)
PTHH: CuO + H2 -to-> Cu + H2O
b) nH2=nCuO=nCu=0,2(mol)
=>V(H2,đktc)=0,2.22,4=4,48(l)
c) mCuO=0,2.80=16(g)

CuO+H2-to>Cu+H2O
0,09----0,09---0,09
n CuO=\(\dfrac{7,2}{80}\)=0,09 mol
=>m Cu=0,09.64=5,76g
=>VH2=0,09.22,4=2,016l
\(n_{CuO}=\dfrac{7,2}{80}=0,09mol\)
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\)
0,09 0,09 0,09 ( mol )
\(m_{Cu}=0,09.64=5,76g\)
\(V_{H_2}=0,09.22,4=2,016l\)
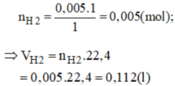
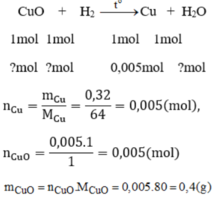
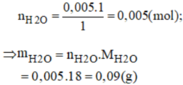
Ta có: \(n_{Cu}=\dfrac{0,32}{64}=0,005\left(mol\right)\)
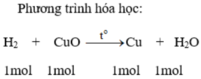
a, PTHH: CuO + H2 -to-> H2 + CuO
b, Ta có: \(n_{CuO}=n_{H_2}=n_{Cu}=0,005\left(mol\right)\)
=> \(m_{CuO}=0,005.80=0,4\left(g\right)\)
c) \(V_{H_2\left(đktc\right)}=0,005.22,4=0,112\left(l\right)\)
nCu=m/M=0,32/64=0,005 (mol)
PT:
CuO + H2 -t0-> Cu +H2O
1...........1............1...........1 (mol)
0,005<- 0,005<-0,005->0,005 (mol)
b) => mCuO=n.M=0,005.80=0,4 (g)
c) VH2=n.22,4=0,005.22,4=0,112(lít)