Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Cho hỗn hợp gồm N2, H2, NH3 đi qua dung dịch H2SO4 đặc, dư thì chỉ có NH3 phản ứng
2NH3+ H2SO4→ (NH4)2SO4
Sau phản ứng thể tích khí còn một nửa
→ %VNH3= 50%

- Đáp án A
- Khi cho hỗn hợp khí (gồm CH4 và C2H4 ) đi qua dung dịch brom thì C2H4 sẽ phản ứng hết với dung dịch brom, CH4 không tác dụng sẽ đi ra khỏi bình.
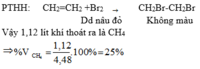

Đáp án D
Gọi a là số nguyên tử C của A, B
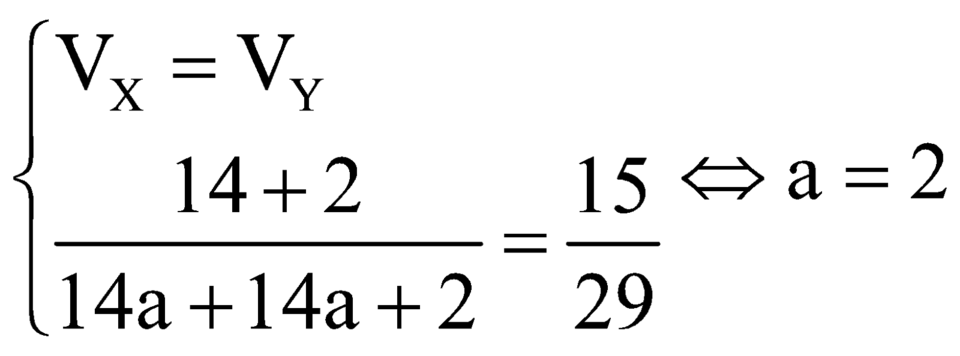
Do đó A, B lần lượt là C2H6, C2H4
Vậy ![]()

Khi cho hỗn hợp gồm N2, H2và NH3 đi qua dung dịch H2SO4 đặc, dư thì toàn bộ NH3 bị hấp thụ.
Theo giả thiết thì sau khi đi qua dung dịch H2SO4 đặc thì thể tích khí còn lại một nửa
\(\rightarrow\)Coi\(\text{ V(NH3 )=1}\) thì\(\text{ V(N2) +V(H2)=1 (1)}\)
\(\frac{\text{(1.17+VN2.28+VH2.2)}}{2}.100\%\)=8x2(2)
Giải (1) và (2) ta có \(\text{V (N2)=0,5, V(NH3)=0,5}\)
%N2=%VH2=\(\frac{0,5}{2}.100\%\)=25%
%NH3 =50%

ankan A và anken B có cùng số C ⇒ MA – MB =2
Cho hỗn hợp X đi qua nước Br2 dư thì thể tích khí Y còn lại bằng nửa thể tích X
⇒ n ankan = n anken
Khí Y chính là ankan A .
mY = 15/29 mX ⇒ MA = 15 /29 (MA + MB) = 15/29 ( 2MA – 2)
⇒ MA = 30 ⇒ A là C2H6 ⇒ B là C2H4
Đáp án D.

Đáp án : D
Do dẫn qua Brom dư nên => anken bị giữ lại, thể tích còn lại 1/2 => Vanken = Vankan = 0,5 mol
=> 50%nA = nB
29.mY = 15.mX.
nY = nA
--> 29.nA.MA = 15.(nA.MA + nB.MB)
14.MA = 15.MB
--> MA = 30 ( C2H6 )
MB = 28 ( C2H4 )

Gọi hh khí ban đầu là X và hh khí sản phẩm là Y.
\(d_{\dfrac{X}{H_2}}=3,6\rightarrow M_X=3,6.2=7,2\left(\dfrac{g}{mol}\right)\)
Ta có:
\(\dfrac{n_{N_2}}{n_{H_2}}=\dfrac{7,2-2}{28-7,2}=\dfrac{5,2}{20,8}=\dfrac{1}{4}\) ( quy tắc đường chéo )
Gọi x là số mol N2 tham gia phản ứng.
PTHH:
\(N_2+3H_2\xrightarrow[Fe]{t^o}2NH_3\)
Trc p/ư: 1 4
p/ư: x 3x 2x (mol)
sau p/ư: 1-x 4-3x 2x
\(\rightarrow n_Y=1-x+4-3x+2x=5-2x\left(mol\right)\)
\(d_{\dfrac{Y}{H_2}}=4,5\rightarrow M_Y=4,5.2=9\left(\dfrac{g}{mol}\right)\)
BTKL: mX = mY
\(m_Y=1.28+4.2=36\left(g\right)\)
\(\rightarrow\dfrac{36}{9}=5-2x\)
\(\rightarrow x=0,5\)
Giả sử phản ứng xảy ra hoàn toàn:
\(\dfrac{1}{1}< \dfrac{4}{3}\) --> N2 hết, H2 dư.
Trước:
\(\%V_{N_2}=\dfrac{1.22,4}{5.22,4}.100\%=20\%\)
\(\%V_{H_2}=100\%-20\%=80\%\)
Sau:
\(\%V_{NH_3}=\dfrac{1.22,4}{4.22,4}.100\%=25\%\)
\(\%V_{N_2}=\dfrac{\left(1-0,5\right).22,4}{4.22,4}.100\%=12,5\left(\%\right)\)
\(\%V_{H_2}=\dfrac{\left(4-1,5\right).22,4}{4.22,4}.100\%=62,5\%\)