Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Cho m gam hỗn hợp rắn gồm Fe, Fe(NO3)2 vào dung dịch chứa 0,08 mol Cu(NO3)2, 0,02 mol Fe(NO3)3 và HCl thu được dung dịch X và hỗn hợp hai khí không màu, có một khí hóa nâu trong không khí là NO
Ta có: M - Y = 76 3 nên khí còn lại là H2 và tỉ lệ số mol NO: H2 là 5:1.
Cho AgNO3 dư vào dung dịch X thấy thoát ra 0,045 mol khí NO nên H+ dư trong X là 0,18 mol, do vậy X không chứa NO3-.
Mặt khác vì còn lại rắn không tan nên trong X chỉ chứa Fe2+ nên X chứa HCl dư và FeCl2.
Do còn H+ dư nên Fe hết ® rắn còn lại là Cu 0,08 mol
→ 32 m 255 = 0 , 08 . 32 → m = 20 , 4 = 180 a + 56 b
Gọi số mol Fe(NO3)2 là a mol; Fe là b mol và HCl là c mol
Bảo toàn N: n N O = 2 a + 0 , 22 m o l → n H 2 = 0 , 4 a + 0 , 044
Bảo toàn H: c= 0,18+4(2a+0,22)+2(0,4a+0,044)
→ n F e C l 2 = 0 , 5 c - 0 , 09
Bảo toàn nguyên tố Fe: 0,02+a+b= 0,5c-0,09
Giải hệ: a=0,04; b=0,6; c=1,5
Bảo toàn Cl: n A g C l = 1 , 5 m o l
Bảo toàn e: n A g = n F e 3 + t r o n g X - 3 n N O = 0 , 66 - 0 , 045 . 3 = 0 , 525 → m = m A g + m A g C l = 271 , 95 g a m

Chọn C.
Hỗn hợp X gồm Al và Fe với số mol mỗi chất bằng 0,2 mol
Hỗn hợp Y gồm Cu(NO3)2 (0,2x mol) và AgNO3 (0,2y mol)
Hỗn hợp Z gồm Ag, Cu và Fe dư Þ nFe dư = 0,1 mol và 64.0,2x + 108.0,2y = 40,8 (1)
→ B T : e 0 , 2 . 3 + 2 . 0 , 2 - 0 , 1 = 0 , 2 x . 2 + 0 , 2 y 2
Từ (1), (2) suy ra: x = 1,5

Chọn đáp án A
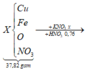
Vì Z gồm 3 kim loại ⇒ Z gồm Ag, Cu, Fe.
+ Z phản ứng HCl dư ⇒ 0,05 mol H2 ⇒ nFedư = 0,05 mol
+ Sơ đồ bài toán ta có:
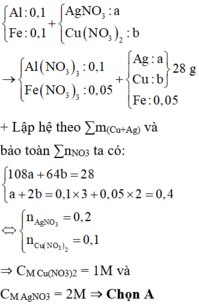

Đáp án : B
Vì kim loại tan hết nên HNO3 dư
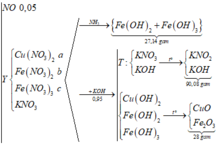
Khi X + KOH => thu được kết tủa
+) Giả sử KOH dư => chất rắn 16,0g gồm Fe2O3 ; CuO (*)
Khi đó T gồm KNO3 và KOH => Nung lên thành KNO2 và KOH với số mol lần lượt là x và y
=> 41,05 = 85x + 56y
Và nK = 0,5 = x + y
=> x = 0,45 mol ; y = 0,05 mol
Gọi số mol Fe và Cu trong A lần lượt là a và b mol
=> 56a + 64b = 11,6g
Và 80a + 80b = 16g (*)
=> a = 0,15 mol ; b = 0,05 mol
+) Nếu chỉ có Fe3+ và Cu2+ => nKOH < 3nFe + 2nCu ( Vô lí )
=> Trong X có Fe2+ : u mol và Fe3+ : v mol
=> HNO3 phải hết
=> u + v = 0 , 15 2 u + 3 v = 0 , 45 => u = 0 , 1 v = 0 , 05
Có nFe(NO3)3 = 0,05 mol
Ta thấy mN2 < mB < mNO2
=> 0,35.28 < mB < 46.0,7
=> 9,8 < mB < 32,2g
BTKL : 66,9g < mdd sau < 89,3g
=> 13,55% < %mFe(NO3)3 < 18,09%


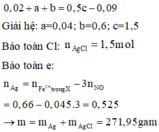




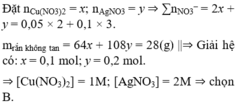
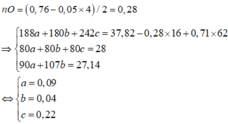

Chọn đáp án B.
Vì trong dung dịch có chất rắn không tan → Không thể có Fe(NO3)3 và HNO3 được
Nếu dung dịch X chỉ chứa Cu(NO3)2 thì Fe chính là phần không tan → Không hợp lý vì Cu2+ có thể oxi hóa Fe
Nếu dung dịch X chỉ chứa Fe(NO3)2 thì Cu (có thể có cả Fe) chính là phần không tan → Hợp lý vì Fe 2+ không phản ứng với cả Fe và Cu