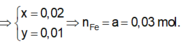Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Cu_2S}=n_{FeS}=a\left(mol\right)\\ 160a+88a=24,8\left(g\right)\\ \rightarrow n_{Cu_2S}=n_{FeS}=0,1\left(mol\right)\)
PTHH:
Cu2S + 6H2SO4 ---> 2CuSO4 + 5SO2 + 6H2O
0,1 ------> 0,6 ----------> 0,2 ------> 0,5 ------> 0,6
2FeS + 10H2SO4 ---> Fe2(SO4)3 + 9SO2 + 10H2O
0,1 ------> 0,5 -----------> 0,05 --------> 0,45 ---> 0,5
\(\rightarrow\left\{{}\begin{matrix}V_{SO_2}=\left(0,5+0,45\right).22,4=21,28\left(l\right)\\n_{H_2SO_4}=0,5+0,6=1,1\left(mol\right)\end{matrix}\right.\)
PTHH:
Fe2(SO4)3 + 6KOH ---> 2Fe(OH)3 + 3K2SO4
0,05 ------------------------> 0,1
CuSO4 + 2KOH ---> Cu(OH)2 + K2SO4
0,2 -----------------------> 0,2
2Fe(OH)3 --to--> Fe2O3 + 3H2O
0,1 ------------------> 0,05
Cu(OH)2 --to--> CuO + H2O
0,2 ----------------> 0,2
\(\rightarrow\left\{{}\begin{matrix}m=107.0,1+98.0,2=20,5\left(g\right)\\a=0,05.160+0,2.80=24\left(g\right)\end{matrix}\right.\)

Đáp án C.
Bảo toàn e ta có:
nMg.2 + nAl.3 + nZn.2 = nspk.x (x là số e thay đổi của sản phẩm khử)
0,08.2 + 0,08.3 + 0,08.2 = 0,07. x => x = 8 => Sản phẩm khử là H2S

a) Gọi nCu = a (mol) => nFe = a (mol)
=> 64a + 56a = 12
=> a = 0,1 (mol)
PTHH:
Cu + 2H2SO4 (đặc, nóng) ---> CuSO4 + SO2 + 2H2O
0,1------------------------------------------->0,1
2Fe + 6H2SO4 (đặc, nóng) ---> Fe2(SO4)3 + 3SO2 + 6H2O
0,1--------------------------------------------------->0,3
=> VSO2 = (0,3 + 0,1).22,4 = 8,96 (l)
b) \(n_{hh}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(M_{hh}=24,5.2=49\left(\dfrac{g}{mol}\right)\)
Áp dụng sơ đồ đường chéo, ta có:
\(\dfrac{n_{SO_2}}{n_{H_2S}}=\dfrac{V_{SO_2}}{V_{H_2S}}=\dfrac{64-49}{49-34}=\dfrac{1}{1}\)
\(\rightarrow n_{SO_2}=n_{H_2S}=\dfrac{0,1}{2}=0,05\left(mol\right)\)
PTHH:
2R + 2nH2SO4 (đặc, nóng) ---> R2(SO4)n + nSO2 + 2nH2O
\(\dfrac{0,1}{n}\)<------------------------------------------------0,05
8R + 5nH2SO4 (đặc, nóng) ---> 4R2(SO4)n + nH2S + 4nH2O
\(\dfrac{0,4}{n}\)<-------------------------------------------------0,05
\(\rightarrow n_R=\dfrac{0,1}{n}+\dfrac{0,4}{n}=\dfrac{0,5}{n}\left(mol\right)\\ \rightarrow M_R=\dfrac{4,5}{\dfrac{0,5}{n}}=9n\left(\dfrac{g}{mol}\right)\)
Xét n = 3 thoả mãn => MR = 27 (g/mol)
Vậy R là Al

Đáp án D
Sơ đồ phản ứng:
X ⏟ 1 mol Y ⏟ 1 mol + H 2 S + 6 O 4 ( đ ặ c ) → t 0 F e + 3 2 ( SO 4 ) 3 + S + 4 O 2 ⏟ 2 mol + H 2 O
Các quá trình nhường electron đối với Fe và hợp chất của sắt:
Gọi M là chất chung cho X, Y và k là số electron trao đổi của M trong phản ứng
![]()
Các quá trình nhường, nhận electron:
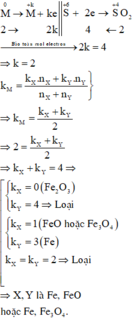

Ta có: \(n_{SO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(n_S=\dfrac{4,8}{32}=0,15\left(mol\right)\)
Coi hh chất rắn gồm M và O.
⇒ nO = 0,15.2 = 0,3 (mol)
Ta có: \(n_M=\dfrac{16,2}{M_M}\left(mol\right)\)
BT e, có: n.nM = 2nO + 2nSO2 + 6nS
\(\Rightarrow\dfrac{16,2n}{M_M}=1,8\Rightarrow M_M=9n\left(g/mol\right)\)
Với n = 3 thì MM = 27 (g/mol) là thỏa mãn.
Vậy: M là Al.