Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C.
Fe + CuSO 4 → FeSO 4 + Cu
n Fe = x mol
Khối lượng Fe phản ứng (cũng là khối lượng sắt trong hỗn hợp đầu) là 56x. Khối lượng Cu sinh ra 64x.
CuSO 4 dư nên chất rắn sau phản ứng là đồng :
10 - 56x + 64x = 11 → x = 1/8 mol
m Fe trong hỗn hợp đầu là: 56 x 1/8 = 7g
% m Fe = 7/10 x 100% = 70%
% m C u = 100% - 70% = 30%

\(m_{cr}=m_{Fe}=12.8\left(g\right)\)
\(NaOH+Al+H_2O\rightarrow NaAlO_2+\dfrac{3}{2}H_2\)
\(m_{Al}=m_{hh}-m_{Fe}=18.2-12.8=5.4\left(g\right)\)
\(\%m_{Al}=\dfrac{5.4}{18.2}\cdot100\%=29.67\%\)

a. PTHH:
Cu + HCl ---x--->
Fe + 2HCl ---> FeCl2 + H2
Vậy chất rắn A là Cu.
b. Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PT: \(n_{Fe}=n_{H_2}=0,3\left(mol\right)\)
=> \(m_{Fe}=0,3.56=16,8\left(g\right)\)
=> \(\%_{m_{Fe}}=\dfrac{16,8}{30}.100\%=56\%\)
\(\%_{m_{Cu}}=100\%-56\%=44\%\%\)
c.
Theo PT: \(n_{FeCl_2}=n_{Fe}=0,3\left(mol\right)\)
=> \(m_{FeCl_2}=0,3.127=38,1\left(g\right)\)
d.
Ta có: \(m_{dd_{FeCl_2}}=100+16,8=116,8\left(g\right)\)
=> \(C_{\%_{FeCl_2}}=\dfrac{38,1}{116,8}.100\%=32,62\%\)
ta có Cu ko phản ứng với HCl
-> V khí là do Fe phản ứng hết tạo ra
Fe + 2HCl -> FeCl2 + H2
0,3 .............................0,3
n H2 = 6,72 : 22,4=0,3 mol
m Fe = 0,3.56 =16,8 g
% Fe = 16,8 : 30 .100 = 56 %
% Cu = 100% - 56% = 44%

Chất rắn ko tan là Cu
Đặt \(n_{Mg}=x(mol);n_{Al}=y(mol)\Rightarrow 24x+27y=13-4=9(1)\)
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45(mol)\\ PTHH:Mg+2HCl\to MgCl_2+H_2\\ 2Al+6HCl\to 2AlCl_3+3H_2\\ \Rightarrow x+1,5y=0,45(2)\\ (1)(2)\Rightarrow x=0,15(mol);y=0,2(mol)\\ a,\%_{Cu}=\dfrac{4}{13}.100\%=30,77\%\\ \%_{Mg}=\dfrac{0,15.24}{13}.100\%=27,69\%\\ \%_{Al}=100\%-30,77\%-27,69\%=41,54\%\\ b,\Sigma n_{HCl}=2x+3y=0,9(mol)\\ \Rightarrow V_{dd_{HCl}}=\dfrac{0,9}{2}=0,45(l)\)

\(Mg>Fe\) => `Mg` phản ứng trước
\(Mg+Cu^{2+}\rightarrow Mg^{2+}+Cu^o\)
x----->x-------------------->x
\(Fe+Cu^{2+}\rightarrow Fe^{2+}+Cu^o\)
y----->y----------------->y
Giả sử nếu \(Cu^{2+}\) chuyển hết thành \(Cu^o\)
\(\Rightarrow n_{Cu^o}=n_{Cu^{2+}}=n_{kt}\)
Có \(n_{Cu^{2+}}=0,2.1=0,2\left(mol\right)\)
\(n_{kt}=\dfrac{15,6}{64}=0,24375\left(mol\right)>0,2\left(mol\right)\)
\(\Rightarrow\)Giả sử sai, kim loại Fe trong hỗn hợp X còn dư
Theo đề có: \(m_{Fe.dư}=m_{kt}-m_{Cu}=15,6-0,2.64=2,8\left(g\right)\)
Ta có hệ phương trình:
\(\left\{{}\begin{matrix}24x+56y=9,2-2,8=6,4\\x+y=0,2\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}x=0,15\\y=0,05\end{matrix}\right.\)
a. Trong X có:
\(\left\{{}\begin{matrix}m_{Mg}=24.0,15=3,6\left(g\right)\\m_{Fe}=56.0,05+2,8=5,6\left(g\right)\end{matrix}\right.\)
b
Y: \(\left\{{}\begin{matrix}n_{MgSO_4}=x=0,15\left(mol\right)\\n_{FeSO_4}=y=0,05\left(mol\right)\end{matrix}\right.\)
\(MgSO_4+2NaOH\rightarrow Mg\left(OH\right)_2+Na_2SO_4\)
0,15--------------------->0,15
\(FeSO_4+2NaOH\rightarrow Fe\left(OH\right)_2+Na_2SO_4\)
0,05-------------------->0,05
\(m_{kt}=m_{Mg\left(OH\right)_2}+m_{Fe\left(OH\right)_2}=0,15.58+0,05.90=13,2\left(g\right)\)
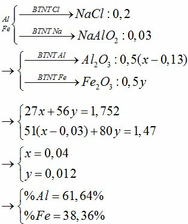
Ta có: m chất rắn = mFe = 5,6 (g)
PT: \(2Al+2NaOH+2H_2O\rightarrow2NaAlO_2+3H_2\)
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PT: \(n_{Al}=\dfrac{2}{3}n_{H_2}=0,2\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{5,6}{5,6+0,2.27}.100\%\approx50,91\%\\\%m_{Al}\approx49,09\%\end{matrix}\right.\)