Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Thể tích hỗn hợp khí thu được.
Trong 1000 kg than có: 1000 x92/100 = 920 kg cacbon
C + H 2 O → CO + H 2
12g 22,4l 22,4l
12kg 44,8 m 3
920kg 44,8x920/12 = 3434,7 ( m 3 ) hỗn hợp khí
Thể tích hỗn hợp khí thực tế thu được: 3434,7 x 85/100 = 2919,5 m 3

A, Gọi X,y lần lượt là số mol của Mg và Al
Pthh:
Mg + H2SO4---> MgSO4 + H2
X. X. X. X
2Al + 3H2SO4---> Al2(SO4)3+3H2
Y. 1.5y. Y. 1.5y
Ta có pt:
24x + 27y= 1.95
X+1.5y=2.24/22.4=0.1
=> X=0.025, Y=0.05
%Mg= 0.025×24×100)/1.95=30.8%
%Al= 100%-30.8%=69.2%
mH2SO4= 0.025+1.5×0.05=0.1g
mH2= (0.025+0.05)×2=0.15g
C, Mdd H2SO4 = 0.1/6.5×100=1.54g
MddY= 1.54+1.95-0.15=3.34g
%MgSO4 vs %Al2(SO4)3 b tự tính nha

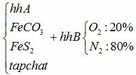
a) Gọi số mol của FeCO3: x (mol) ;
số mol của FeS2: y (mol)
4FeCO3 + O2 → Fe2O3 + 4CO2↑
x → 0,25x → x (mol)
4FeS2 +11O2 → 2Fe2O3 + 8SO2↑
y → 2,75y → 2y (mol)
∑ nO2 = 0,25x + 2,75y (mol)
Cùng điều kiện về nhiệt độ và áp suất nên tỉ lệ về thể tích = tỉ lệ về số mol
=> nN2 = 4nO2 = 4(0,25x + 2,75y)
=> nN2 = x + 11y (mol)
Vậy hỗn hợp Y gồm:
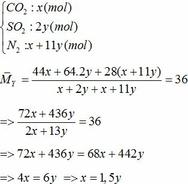
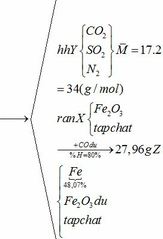
Khối lượng Fe có trong Z là:
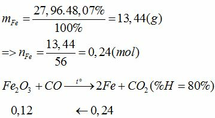
Vì H = 80% => nFe2O3 (trong X) = 0,12. 100% : 80% = 0,15 (mol)
nFe2O3 dư (trong Z) = 0,15 – 0,12 = 0,03 (mol)
Khối lượng tạp chất trong Z = 27,96 – mFe – mFe2O3 dư = 27,96 – 0,24.56 – 0,03.160 = 9,72 (g)
Bảo toàn nguyên tố Fe => nFeCO3 + nFeS2 = 2nFe2O3(trong X)
=> x + y = 0,3 (2)
Từ (1) và (2) => x = 0,18 và y = 0,12 (mol)
Áp dụng công thức PV = nRT ( với n = nCO2 + nSO2 + nN2 = 0,18 + 2. 0,12 + 0,18 +11.0,12 = 1,92)
=> P.10 = 1,92.0,082. (136,5 +273)
=> P = 6,447 ( atm) ≈ 6,5 (atm)
Ta có: mA = mFeCO3 + mFeS2 + mtạp chất = 0,18.116 + 0,12.120 + 9,72 = 45 (g)
![]()
b) hỗn hợp Y gồm:
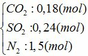
Cho hỗn hợp Y qua O2 ( xúc tác V2O5 ) có phản ứng sau:
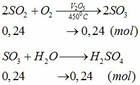
Khối lượng dd sau: mdd sau = mSO3 + mH2O = 0,24. 80 + 592,8 = 612 (g)
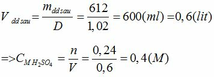

a.
BTKL ta có mX = mY => nX . MX = nY . mY
MX / My = nY / mY =0.75
Đặt nX = 1 mol => nY = 0,75 mol => nH2 phản ứng = 1 – 0,75 = 0,25mol
* TH hidrocacbon là anken: n anken = n H2 = 0,25 mol => n H2 trong X = 0,75 => M = (6,75 – 0,75 . 2)/0,25 = 21 (loại) * TH là ankin: => n akin = 0,25/2 = 0,125 => n H2 trong X = 0,875 mol => M = (6,75 – 0,875 . 2)/0,125 = 40 =>C3H4
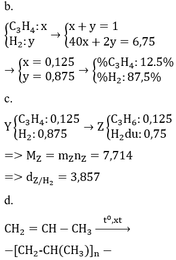


Câu 1 :
\(n_C = \dfrac{1 000 000.92\%}{12} = \dfrac{230000}{3}(mol)\\ \Rightarrow n_{CO} = n_C.H\% = \dfrac{230000}{3}.85\% = \dfrac{195500}{3}(mol) \\ V_{CO} = \dfrac{195500}{3}.22,4 = 1459733,33(lít)\)
Câu 2 :
\(n_{C\ pư} = n_{CO} = \dfrac{1428.1000}{22,4} = 63750(mol)\\ n_{C\ đã\ dùng} = \dfrac{63750}{80\%} = 79687,5(mol)\\ m_{than} = \dfrac{m_C}{92\%} = \dfrac{79687,5.12}{92\%} = 1039402,1(gam)\)

1)Khí sau phản ứng gồm :
CO : a(mol)
CO2:b(mol)
Bảo toàn nguyên tố với C: a + b = \(\dfrac{6,72}{22,4} = 0,3(mol)\)(1)
\(M_{khí} = 20.2 = 40(đvC)\)
Ta có : 28a + 44b = (a + b).40(2)
Từ (1)(2) suy ra : a = 0,075; b = 0,225
\(CO + O_{oxit} \to CO_2\\ n_{O(oxit)} = n_{CO_2} = 0,225(mol)\\ m_{Fe} + m_O = m_{oxit}\\ \Rightarrow n_{Fe} = \dfrac{13,05-0,225.16}{56}=0,16875(mol)\)
Ta thấy : \(\dfrac{n_{Fe}}{n_O} = \dfrac{0,16875}{0,225} = \dfrac{3}{4}\)
Vậy oxit cần tìm : Fe3O4
2) \(\%V_{CO_2} = \dfrac{0,225}{0,225+0,075}.100\% = 75\%\)

\(n_{H_2}=\dfrac{3,36}{22,4}0,15(mol)\\ a,PTHH:Fe+H_2SO_4\to FeSO_4+H_2\\ b,n_{Fe}=n_{H_2}=0,15(mol)\\ \Rightarrow \%_{Fe}=\dfrac{0,15.56}{14,8}.100\%=56,76\%\\ \Rightarrow \%_{Cu}=100\%-56,76\%=43,24\%\\ c,n_{H_2SO_4}=0,15(mol)\\ \Rightarrow m_{dd_{H_2SO_4}}=\dfrac{0,15.98}{20\%}=73,5(g)\\ \Rightarrow V_{dd_{H_2SO_4}}=\dfrac{73,5}{1,4}=52,5(l)\)

Khối lượng cacbon trong 1 tấn than: 1000x90/100 = 900 tấn
2C + O 2 → 2CO
2x12kg 2x22,4 m 3
900kg x m 3
x = 900 x 2 x 22,4/(2x12) = 1680 ( m 3 )
Thực tế, thể tích khí CO thu được là: 1680 x 85/100 = 1428 ( m 3 )

\(m_{C}=1000.90\%=900(kg)\\ n_{C}=\dfrac{900}{12}=75(kmol)\\ PTHH:2C+O_2\to 2CO\\ \Rightarrow n_{CO}=75(kmol)\\ \Rightarrow V_{CO}=75.1000.22,4=1680000(l)\\ \Rightarrow V_{CO(tt)}=1600000.85\%=1428000(l)\)
Trên mạng có đó bạn ( Trên Yahoo đó )
Khối lượng C = 92%* 1000 = 920 kg => số kmol C = 76,67 kmol
Gọi x và y là số kmol C đã p/ư => x+y = 85%* 76,67= 65,167 kmol
C + H2O--------> CO +H2
x----------------------x------x kmol
C + 2H2O--------> CO2 + 2H2
y------------------------y-------2y kmol
CO2 không khử Fe2O3
3 CO + Fe2O3 -----> 2Fe + 3 CO2
--x-------------------------2x/3 kmol
3H2 + Fe2O3--------> 2Fe + 3H2O
x+2y--------------------->2(x+2y)/3
Số kmol Fe thu được = 2x/3 +2x/3 + 4y/3 = 4(x+y)/3 = (4*65,16)/3 = 86,89 kmol
khối lượng Fe thu được = 86,89*56 =4865,8 kg