Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
$KOH + SO_2 \to KHSO_3$
Theo PTHH : $n_{KOH} = n_{KHSO_3} = n_{SO_2} = 0,4.0,5 = 0,2(mol)$
$V_{SO_2} = 0,2.22,4 = 4,48(lít)$
$C_{M_{KHSO_3}} = \dfrac{0,2}{0,4} = 0,5M$
b)
$2KOH + SO_2 \to K_2SO_3 + H_2O$
$n_{K_2SO_3} = n_{SO_2} = \dfrac{1}{2}n_{KOH} = 0,1(mol)$
$V_{SO_2} = 0,1.22,4 = 2,24(lít)$
$C_{M_{K_2SO_3}} = \dfrac{0,1}{0,4} = 0,25M$

(a)- Khi cho E tác dụng với NaHCO3 sinh ra V lít khí (CO2) và muối natri của X => X là axit
- Ta thấy thể tích khí sinh ra khi cho E tác dụng với Na (khí H2) lớn hơn 0,5 lần thể tích khí khi cho E tác dụng với NaHCO3 (khí CO2) => Y là ancol
Vậy E gồm axit X, ancol Y và este Z (tạo bởi X, Y)
Giả sử V lít tương ứng với 1 (mol) khí
+ nCO2 = n-COOH = 1 (mol)
+ nH2 = 0,5n-COOH + 0,5n-OH => 0,75 = 0,5.1 + 0,5n-OH => n-OH = 0,5 (mol)
+ n hỗn hợp = 2nH2 = 1,5 mol => nX = nY = nZ = 1,5:3 = 0,5 mol
Số chức của axit X là: 1 : 0,5 = 2
Số chức của ancol Y là: 0,5 : 0,5 = 1
=> Este Z có 2 chức
* Đốt cháy muối natri của X:
Muối natri của X có dạng RO4Na2
Gọi số mol muối của X là x (mol)
BTNT Na: nNa2CO3 = n muối = x (mol)
BTNT O: 4n muối + 2nO2 = 2nCO2 + nH2O + 2nNa2CO3
=> 4x + 2nO2 = 0,03.2 + 0,02 + 3x => nO2 = 0,04 – 0,5x (mol)
BTKL: m muối + mO2 = mCO2 + mH2O + mNa2CO3
=> 1,62 + 32(0,04 - 0,5x) = 0,03.44 + 0,02.18 + 106x
=> x = 0,01 mol
=> M muối = 162 => R + 16.4 + 23.2 = 162 => R = 28 => CTPT của X là C4H6O4
* Đun nóng Y với H2SO4 đặc thu được Y1 có tỉ khối so với Y là 34/43 => phản ứng tách nước tạo anken
=> MY1 = MY – 18
=> dY1/Y = (MY-18)/MY = 34/43 => MY = 86 (C5H10O)
Mà khi đun Y1 với KMnO4/H2SO4 thu được Y2 duy nhất, không có khí thoát ra, Y2 có cấu tạo mạch thẳng và là điaxit nên Y1 có cấu tạo mạch vòng, chứa 1 liên kết đôi.
- Cấu tạo Y1:
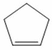
- Cấu tạo Y2: HOOC-(CH2)3-COOH
- Cấu tạo Y: 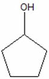
- Cấu tạo X:
HOOC-CH2-CH2-COOH hoặc HOOC-CH(CH3)-COOH
- Cấu tạo Z:
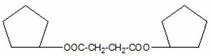
Hoặc
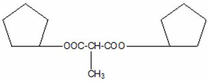
(b)Giả sử số mol mỗi chất trong ½ hỗn hợp G:
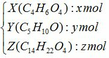
- Khối lượng của ½ hỗn hợp G:
118x + 86y + 254z = 7,8 (1)
- Đốt cháy phần 1 cần nO2 = 9,408 : 22,4 = 0,42 mol:
C4H6O4 + 3,5 O2 → 4CO2 + 3H2O
x 3,5x
C5H10O + 7O2 → 5CO2 + 5H2O
y 7y
C14H22O4 + 17,5O2 → 14CO2 + 11H2O
z 17,5z
Ta có: nO2 = 0,42 => 3,5x + 7y + 17,5z = 0,42 (2)
- Phần 2 tác dụng vừa đủ với nNaOH = 0,04.2 = 0,08 mol:
C2H4(COOH)2 + 2NaOH → C2H4(COONa)2 + 2H2O
x 2x x
C2H4(COOC5H9)2 + 2NaOH → C2H4(COONa)2 + 2C5H9OH
z 2z z 2z
nNaOH = 2nX + 2nZ => 2a + 2c = 0,08 (3)
Từ (1) (2) (3) ta có hệ phương trình:
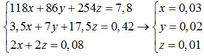
Sau phản ứng thu được:
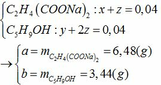

nFe =mFe /MFe =14/56=0,25(mol)
Fe +2HCl ----}FeCl2 +H2. 1 :2. : 1. : 1. 0,25. 0,5. 0,25. 0,25
a)Sản phẩm của phản ứng gồm FeCl2 và H2. b)Số mol sắt tham gia phải ứng là 0,25 mol. c)Tỉ lệ số mol HCl phản ứng và số mol muối thu được là 2:1. d)VH2=nH2×22,4 =0,25×22,4=5,6(L). e)V(HCl)=nHCl /2=0,5 /2=0,25(L). f)m(FeCl2)=n(FeCl2)×m(FeCl2)=0,25×127=31,75(g)

nNaOH=0,2mol
a) PTHH: 2NaOH+H2SO4=> Na2SO4+2H2O
0,2=>0,1
=> V H2SO4=0,1:0,5=0,2l=200ml
b) 2NaOH+SO2=>Na2SO3+H2O
2/15=>1/15
NaOH+SO2=>NaHSO3
1/15=>1/15
=> VSO2=2.1/15.22,4=2,98l

\(T=\dfrac{n_{NaOH}}{n_{CO_2}}=1\rightarrow\)Phản ứng tạo muối axit hay NaHCO3
=> B

a)
Gọi $n_{Na_2CO_3} = a(mol) \to n_{NaHCO_3} = 1,4a(mol)$
$2NaOH + CO_2 \to Na_2CO_3 + H_2O$
$NaOH + CO_2 \to NaHCO_3$
Theo PTHH :
$n_{NaOH} = 2a + 1,4a = 3,4.0,5(mol)$
$\Rightarrow a = 0,5$
$C + O_2 \xrightarrow{t^o} CO_2$
$n_C = n_{CO_2} = n_{Na_2CO_3} + n_{NaHCO_3} = 0,5 + 0,7 = 1,2(mol)$
$m_C = 1,2.12 = 14,4(gam)$
b)
$CaCl_2 + Na_2CO_3 \to CaCO_3 + H_2O$
n CaCl2 = n CaCO3 = n Na2CO3 = 0,5(mol)
=> V dd CaCl2 = 0,5/1 = 0,5(lít)
m CaCO3 = 0,5.100 = 50(gam)
c)
$NaHCO_3 + Ca(OH)_2 \to CaCO_3 + NaOH + H_2O$
$Na_2CO_3 + Ca(OH)_2 \to CaCO_3 + 2NaOH$
Ta có :
$n_{CaCO_3} = n_{NaHCO_3} + n_{Na_2CO_3} = 1,2(mol)$
$m_{CaCO_3} = 1,2.100 = 120(gam)$

Chọn C
Vì thể tích dung dịch không thay đổi nên tỉ lệ về nồng độ cũng chính là tỉ lệ về số mol.
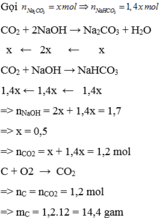
SO3 + H2O ---> H2SO4
H2SO4 + 2NaOH ---> Na2SO4 + H2O
SO2 + 2NaOH ---> Na2SO3 + H2O
SO2 + NaOH ---> NaHSO3
Nếu x >= 2b tạo ra muối Na2SO3
Nếu x <= b tạo ra muối NaHSO3
Nếu b < x < 2b tạo ra cả 2 muối NaHSO3 và Na2SO3.
Với mọi a và x luôn tạo ra muối Na2SO4.