Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a.b.
\(n_{Fe}=\dfrac{2,8}{56}=0,05mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,05 0,1 0,05 ( mol )
\(V_{H_2}=0,05.22,4=1,12l\)
\(m_{HCl}=0,1.36,5=3,65g\)
c.
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\)
0,05 0,05 ( mol )
\(m_{Cu}=0,05.64=3,2g\)

`a)PTHH:`
`Fe + 2HCl -> FeCl_2 + H_2`
`0,3` `0,6` `0,3` `0,3` `(mol)`
`n_[Fe]=[22,4]/56=0,4(mol)`
`n_[HCl]=0,3.2=0,6(mol)`
Ta có:`[0,4]/1 > [0,6]/2`
`=>Fe` dư
`b)m_[FeCl_2]=0,3.127=38,1(g)`
`c)m_[Fe(dư)]=(0,4-0,3).56=5,6(g)`
\(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right)\)
\(n_{HCl}=0,3.2=0,6\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
Xét: \(\dfrac{0,4}{1}>\dfrac{0,6}{2}\) ( mol )
0,3 0,6 0,3 ( mol )
\(m_{FeCl_2}=0,3.127=38,1\left(g\right)\)
\(m_{Fe\left(dư\right)}=\left(0,4-0,3\right).56=5,6\left(g\right)\)

Cho 10,8 g FeO t/d vừa đủ với 100g dung dịch axit clohidric
a. Tính khối lượng axít đã dùng, từ đó suy ra nồng độ % của dung dịch axit?
b. Tính nồng độ % của dung dịch muối thu được sau phản ứng?
Giải:
a) nFeo=10,8/72=0,15
Phương trình hóa học:FeO + 2HCl----->FeCl2+H2O
Theo Phương trình: 1mol 2 mol 1mol
Theo đề bài: 0,15mol 0,3mol 0,15mol
\Rightarrowmhcl=0,3*36,5=10,95g
\Rightarrow C%HCl=mHCl/mDung dich=10,95/100*100=10,95%
b)Từ câu a\Rightarrow mFeCl2=0,15*127=19,05
mdung dich=10,8+100=110,8g
\RightarrowC%FeCl2=19,05/110,8*100=17,19%
PTHH: FeO + 2HCl \(\rightarrow\) FeCl2 + H2O
Ta có: n FeO = \(\frac{10,8}{72}\) = 0,15 mol
Theo p.trình: n HCl=2.nFeO = 2.0,15=0,3 mol
\(\Rightarrow\) mHCl = 0,3 . 36,5 = 10,95g
\(\Rightarrow\) C% dd HCl = \(\frac{10,95}{100}.100\) = 10,95 %
Theo p.trình: nFeCl2 = nFeO = 0,15 mol
\(\Rightarrow\) mFeCl2 = 0,15 . 127 = 19,05 (g)
mdd FeCl2= 10,8 + 100= 110,8 g
\(\Rightarrow\) C% dd muối = \(\frac{19,05}{110,8}.100\) = 17,19%

\(n_{Fe}=\dfrac{28}{56}=0,5mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,5 1 0,5
\(V_{H_2}=0,5\cdot22,4=11,2l\)
\(m_{HCl}=1\cdot36,5=36,5g\)

\(n_{Mg}=\dfrac{7,2}{24}=0,3\left(mol\right);n_{HCl}=\dfrac{29,2}{36,5}=0,8\left(mol\right)\\ Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\\ a,Vì:\dfrac{0,3}{1}< \dfrac{0,8}{2}\Rightarrow HCldư\\ n_{H_2}=n_{MgCl_2}=n_{Mg}=0,3\left(mol\right)\\ n_{HCl\left(dư\right)}=0,8-0,3.2=0,2\left(mol\right)\\ V_{H_2\left(đktc\right)}=0,3.22,4=6,72\left(l\right)\\ b,m_{MgCl_2}=0,3.95=28,5\left(g\right)\\ m_{HCl\left(dư\right)}=0,2.36,5=7,3\left(g\right)\)
a) \(n_{Mg}=\dfrac{7,2}{24}=0,3\left(mol\right)\)
\(n_{HCl}=\dfrac{29.2}{36,5}=0,8\left(mol\right)\)
PTHH : 2Mg + 2HCl -> 2MgCl + H2
Xét tỉ lệ \(\dfrac{0,3}{2}< \dfrac{0,8}{2}\)
=> HCl dư
=> \(V_{H_2}=0,075.22,4=1,68\left(l\right)\)
=> \(V_{MgCl}=0,15.22,4=3,36\left(l\right)\)
b) \(m_{H_2}=0,075.2=0,15\left(g\right)\\ m_{MgCl}=0,15.59,5=8,925\left(g\right)\)

a) $Fe + 2HCl \to FeCl_2 + H_2$
Theo PTHH :
$n_{H_2} = n_{Fe} = \dfrac{11,2}{56} = 0,2(mol)$
$V_{H_2} = 0,2.22,4 = 4,48(lít)$
b) $n_{HCl} = 2n_{Fe} = 0,4(mol)$
$m_{HCl} = 0,4.36,5 = 14,6(gam)$
c) $2H_2 + O_2 \xrightarrow{t^o}2H_2O$
Theo PTHH :
$V_{O_2} = \dfrac{1}{2}V_{H_2} = 2,24(lít)$
$n_{H_2O} = n_{H_2} = 0,2(mol)$
$m_{H_2O} = 0,2.18 = 9(gam)$

\(n_{Fe}=\dfrac{m}{M}=\dfrac{28}{56}=0,5\left(mol\right)\\ PTHH:Fe+2HCl->FeCl_2+H_2\)
ti le 1 : 2 : 1 : 1
n(mol) 0,5-->1--------->0,5------>0,5
\(m_{FeCl_2}=n\cdot M=0,5\cdot\left(56+35,5\cdot2\right)=63,5\left(g\right)\\ V_{H_2\left(dktc\right)}=n\cdot22,4=0,5\cdot22,4=11,2\left(l\right)\)
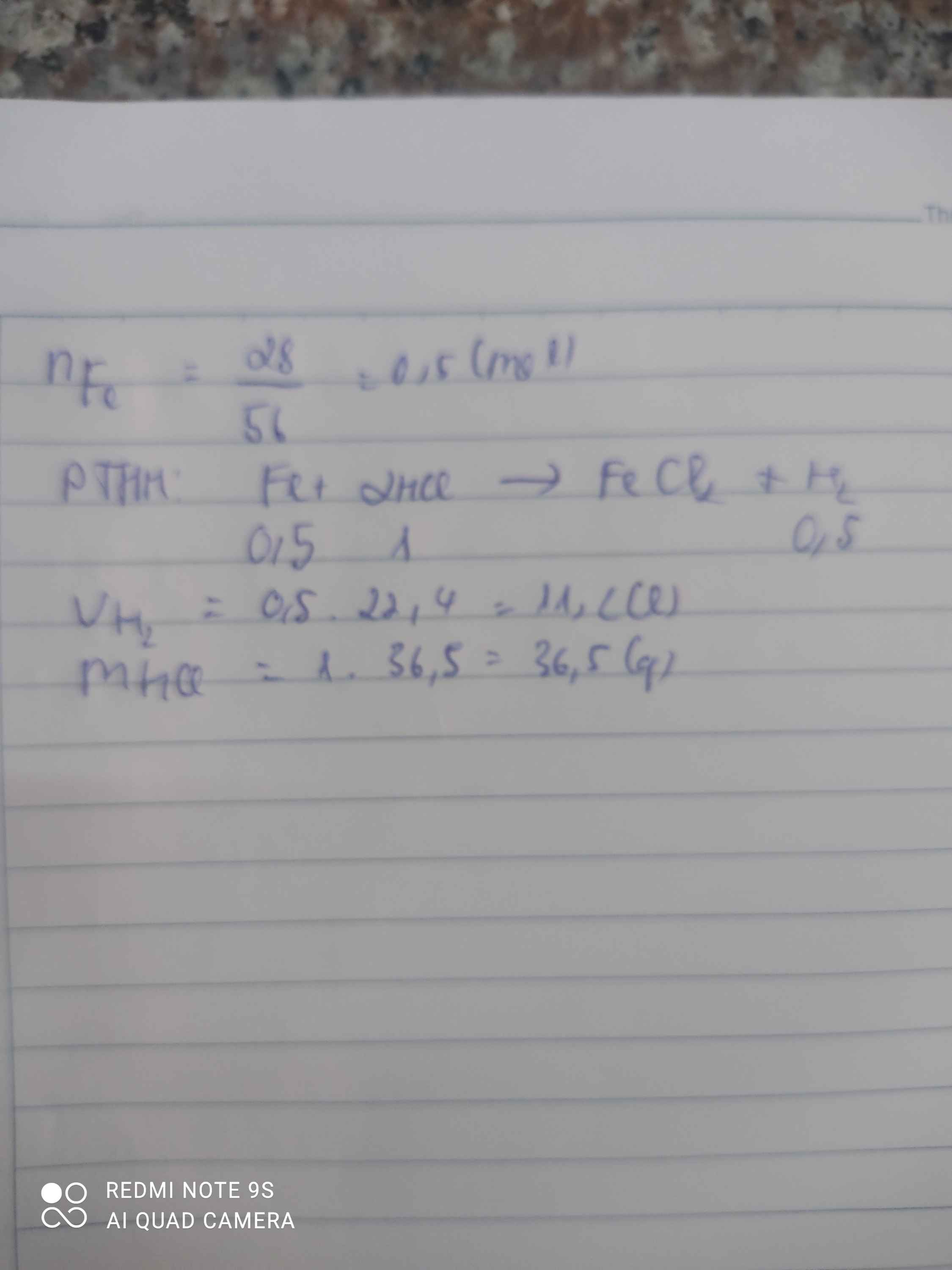
\(n_{HCl}=\dfrac{29,2}{36,5}=0,8\left(mol\right)\\ FeO+2HCl\rightarrow FeCl_2+H_2O\\ n_{FeO}=n_{FeCl_2}=n_{H_2O}=\dfrac{0,8}{2}=0,4\left(mol\right)\\ a,m_{FeO}=72.0,4=28,8\left(g\right)\\ b,C1:m_{sp}=m_{FeO}+m_{HCl}=28,8+29,2=58\left(g\right)\\ C2:m_{sp}=m_{FeCl_2}+m_{H_2O}=127.0,4+18.0,4=58\left(g\right)\)
\(a.n_{HCl}=0,8\left(mol\right)\\ FeO+2HCl\rightarrow FeCl_2+H_2O\\ n_{FeO}=\dfrac{1}{2}n_{HCl}=0,4\left(mol\right)\\ m_{FeO}=0,4.72=28,8\left(g\right)\\ b.n_{FeCl_2}=\dfrac{1}{2}n_{HCl}=0,4\left(mol\right)\\ m_{FeCl_2}=0,4.127=50,8\left(g\right)\\ n_{H_2O}=\dfrac{1}{2}n_{HCl}=0,4\left(mol\right)\\ \Rightarrow m_{H_2O}=0,4.18=7,2\left(g\right)\)