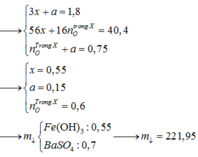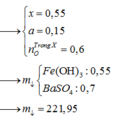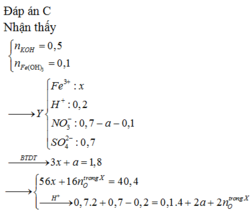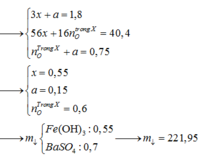Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Thí nghiệm 1 :
\(n_{Mg} = a(mol) ; n_{Fe} = b(mol) \\ \Rightarrow 24a + 56b = 15,6(1)\\ Mg + H_2SO_4 \to MgSO_4 + H_2\\ Fe + H_2SO_4 \to FeSO_4 + H_2\\ n_{H_2} =a + b = 0,3(2)\\ (1)(2) \Rightarrow a = 0,0375 ; b = 0,2625\)
Thí nghiệm 2 : Vì khối lượng thí nghiệm 1 bằng 3 lần khối lượng thí nghiệm 2 nên ở thì nghiệm 2 : \(n_{Mg} = \dfrac{0,0375}{3}=0,0125(mol)\\ n_{Fe} = \dfrac{0,2625}{3} = 0,0875(mol)\\ \text{Bảo toàn electron : }\\ n_{SO_2} = \dfrac{0,0125.2 + 0,0875.3}{2} = 0,14375(mol)\\ m_X - m_{SO_2} = 5,2 - 0,14375.64 = -4\)
Vậy khối lượng dung dịch Z giảm 4 gam so với H2SO4 ban đầu.

Đáp án B.
![]()
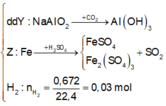
Giả sử Z + H2SO4 → dung dịch muối tạo thành chỉ có Fe2(SO4)3:
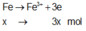
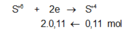
![]()
![]()
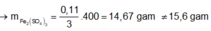
→ muối thu được gồm FeSO4 và Fe2(SO4)3.
Ta có sơ đồ phản ứng:
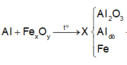
→ + N a O H d ư

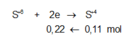
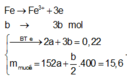
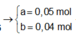
![]()
X tác dụng được với dung dịch NaOH tạo khí H2 →Al dư.
![]()
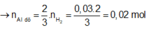
![]()
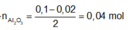
![]()
![]()
![]()
![]()

Đáp án B
Ta nhận thấy mE < mX => KL chưa phản ứng hết; AgNO3 và Cu(NO3)2 hết
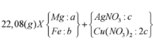
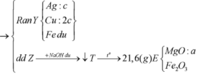
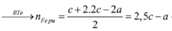
![]()

Xét phần 1: do sinh ra H2 ⇒ Al dư. nH2 = 0,075 mol ⇒ nAl dư = 0,05 mol.
Rắn không tan là Fe. Ta có: 2H2SO4 + 2e → SO2 + SO42– + 2H2O.
⇒ nSO42– = nSO2 = 0,6 mol ⇒ nFe = (82,8 – 0,6 × 96) ÷ 56 = 0,45 mol.
8Al + 3Fe3O4 → 4Al2O3 + 9Fe ⇒ nAl2O3 = 0,45 × 4 ÷ 9 = 0,2 mol.
⇒ mphần 1 = 0,05 × 27 + 0,2 × 102 + 0,45 × 56 = 46,95(g) ⇒ m phần 2 = 187,8(g).
⇒ phần 2 gấp 4 lần phần 1 ⇒ phần 2 chứa 0,2 mol Al; 0,8 mol Al2O3; 1,8 mol Fe.
Ta có: nH+ = 4nNO + 2nNO2 + 2nO + 10nNH4+ ⇒ nNH4+ = 0,015 mol.
Đặt nFe(NO3)2 = b ⇒ a + b = nFe = 1,8 mol; Bảo toàn electron:
0,2 × 3 + 3a + 2b = 1,25 × 3 + 1,51 + 0,015 × 8. Giải hệ có: a = 1,18.
Đáp án D