Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
► Xét TN1: đặt nCO32– phản ứng = a; nHCO3– phản ứng = b.
⇒ nCO2 = a + b = 0,15 mol; nHCl phản ứng = 2a + b = 0,1875 mol
||⇒ giải hệ có: a = 0,0375 mol; b = 0,1125 mol ⇒ nCO32–/X : nHCO3–/X = a : b = 1 : 3.
► Xét TN2: ∑nC/X = n↓ = 0,25 mol ⇒ 250 ml X chứa 0,5 mol C.
Bảo toàn nguyên tố Cacbon: y = 0,5 – 0,25 = 0,25 mol.
● Chia 0,5 mol C thành 0,125 mol CO32– và 0,375 mol HCO3–.
Bảo toàn điện tích: nK+ = 0,625 mol. Bảo toàn nguyên tố Kali:
x = 0,625 – 0,25 × 2 = 0,125 mol

Đáp án B
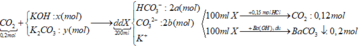
TH1: Nếu trong dd X có OH- dư => dd X chứa OH- dư, CO32-, K+
Khi cho từ từ 100 ml dd X vào 0,15 mol HCl
OH- + H+ → H2O
CO32- + 2H+ → CO2 ↑+ H2O
=> nH+ = nOH- + 2nCO2 > 0,12.2 = 0,24 (mol)
=> loại vì nH+ = 0,15 (mol)
Vậy dd X không chứa OH- dư
TH2: dd X không chứa OH- dư ta có sơ đồ bài toán như trên
Khi cho từ từ 100ml dd X vào 0,15 mol HCl có phản ứng:
HCO3- + H+ → CO2 + H2O
x → x →x (mol)
CO32- + 2H+ → CO2 + H2O
y → 2y → y (mol)

=> a – 3b = 0 (1)
BTNT C: nBaCO3 = a + b = 0,2 (2)
Từ (1) và (2) => a = 0,15 và b = 0,05 (mol)
Trong 200 ml dd X : nHCO3- = 0,3 (mol) ; nCO32- = 0,1 (mol)
Bảo toàn điện tích đối với dd X : nK+ = 0,3 + 0,1.2 = 0,5 (mol)
BTNT C: nCO2(bđ) + nK2CO3 = nHCO3-+ nCO32- => 0,2 + y = 0,3 + 0,1 => y = 0,2 (mol)
BTNT K: nK+ = nKOH + 2nK2CO3 => nKOH = 0,5 – 2.0,2 = 0,1 (mol)
=> x = 0,1 (mol)

Đáp án B
Vì sau khi thêm dung dịch NaOH vào thì khối lượng kết tủa tăng do đó phản ứng AlCl3 dư
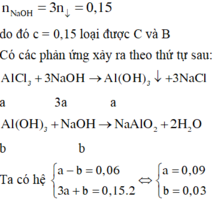
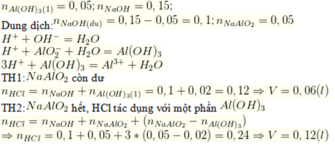

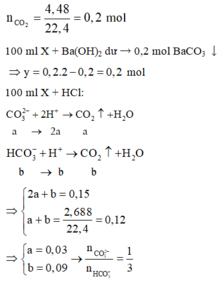
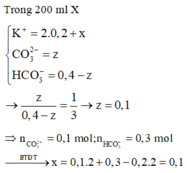

Nhận thấy nkết tủa = 0,02 mol < nNa[Al(OH)4] → Xảy ra 2 trường hợp,
Để thể tích dung dịch HCl là lớn nhất thì xảy ra quá trình hòa tan kết tủa
NaOH + HCl → NaCl + H2O
0,1 ----> 0,1
Na[Al(OH)4] + HCl → Al(OH)3 + H2O
0,02-----------> 0,02-------> 0,02
Na[Al(OH)4] + 4HCl → AlCl3 + 2H2O
0,03-------- ->0,12
Vậy nHCl = 0,1 + 0,02 + 0,12 = 0,24 mol → V= 0,12 lít.
Đáp án C