Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1)
\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\Rightarrow n_{HCl}=0,25.2=0,5\left(mol\right)\)
\(V=\dfrac{0,5}{0,5}=1\left(l\right)\)
2)
\(n_{NaCl}=\dfrac{5,85}{58,5}=0,1\left(mol\right)\); \(n_{AgNO_3}=\dfrac{34}{170}=0,2\left(mol\right)\)
PTHH: NaCl + AgNO3 --> NaNO3 + AgCl
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,2}{1}\) => NaCl hết, AgNO3 dư
PTHH: NaCl + AgNO3 --> NaNO3 + AgCl
0,1------------------------>0,1
=> mAgCl = 0,1.143,5 = 14,35 (g)

Đáp án A
nNaCl = ![]() = 0,2(mol)
= 0,2(mol)
![]()
AgNO3 + NaCl → AgCl + NaNO3
0,3 0,2 → 0,2 (Mol)
(Do AgNO3 dư, nên tính theo NaCl)
mAgCl = 0,2.(108 + 35,5) = 28,7 (g)

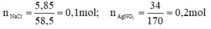
a) Phương trình hóa học của phản ứng:
NaCl + AgNO3 → AgCl↓ + NaNO3
Theo pt: nAgNO3 pư = nAgCl = nNaCl = 0,1 mol
b) Vdd = 300 + 200 = 500 ml
nAgNO3 dư = 0,2 – 0, 1 = 0,1 mol; nNaNO3 = nNaCl = 0,1 mol
CM(NaNO3) = CM(AgNO3) = 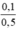 = 0,2 mol/l.
= 0,2 mol/l.

Đáp án D
nNaCl =0,1 mol, nAgNO3 = 0,2 mol
NaCl + AgNO3 → AgCl + NaNO3
0,1 → 0,1 0,1 (mol)
Vdd = 300 + 200 = 500 ml
![]() (dư) = 0,2 - 0,1 =0, 1 (mol)
(dư) = 0,2 - 0,1 =0, 1 (mol)
![]() = 0,1 mol
= 0,1 mol
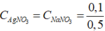 = 0,2 M
= 0,2 M

\(Đặt:\)
\(n_{Fe}=x\left(mol\right)\\ n_{Fe\left(ỌH\right)_2}=y\left(mol\right)\\ n_{FeCO_3}=z\left(mol\right)\)
\(n_{hh}=x+y+z=0.06\left(mol\right)\left(1\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\\ Fe\left(OH\right)_2+2HCl\rightarrow FeCl_2+H_2O\\ FeCO_3+2HCl\rightarrow FeCl_2+CO_2+H_2O\)
\(n_{HCl}=2x+2y+2z=2\left(x+y+z\right)=2\cdot0.06=0.12\left(mol\right)\\ \Rightarrow n_{HCl\left(dư\right)}=0.16-0.12=0.04\left(mol\right)\)
\(n_{FeCl_2}=n_{Fe\left(hh\right)}=0.06\left(mol\right)\)
\(FeCl_2+2AgNO3\rightarrow Fe\left(NO3\right)_2+2AgCl\\ HCl+AgNO3\rightarrow HNO3+AgCl\)
\(n_{AgCl}=2n_{FeCl_2}+n_{HCl\left(dư\right)}=2\cdot0.06+0.04=0.16\left(mol\right)\)
\(m_{AgCl}=0.16\cdot143.5=22.96\left(g\right)\)

Chọn đáp án A
Kết tủa là AgCl.
n A g C l = n N a C l = 0,1.0,1 = 0,01 mol => m = 0,01.143,5 = 1,435 (gam)

Đáp án B
Có phản ứng:
Nhận thấy: 1 mol AgX nặng hơn 1 mol NaX là
(108 – 23) = 85 (gam)
Do đó số mol NaX tham gia phản ứng là:
n N a X = n A g X = 14 , 35 - 5 , 85 85 0 , 1 ( m o l )
⇒ M N a X = 5 , 85 0 , 1 = 58 , 5 ⇒ 23 + X = 58 , 5 ⇔ X = 35 , 5
⇒ x 1 + x 2 = 100 35 x 1 + 37 x 2 100 = 35 , 5 ⇔ x 1 = 75 x 2 = 25

Có phản ứng:
![]()
Nhận thấy: 1 mol AgX nặng hơn 1 mol NaX là
(108 – 23) = 85 (gam)
Do đó số mol NaX tham gia phản ứng là:

Đáp án B
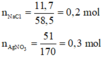

n\(_{NaCl}=\dfrac{5,85}{58,5}=\)0,1(mol)
n\(_{AgNO_3}=\dfrac{34}{170}\) =0,2(mol)
\(NaCl+AgNO_3\rightarrow AgCl\downarrow+NaNO_3\)
bđ: 0,1 0,2 (mol)
pư: 0,1 0,1 0,1 0,1 (mol)
dư: 0 0,1 0 0 (mol)
m\(_{AgCl}=0,1.143,5=14,35\left(g\right)\)