Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Khi hạ nhiệt độ của bình thì màu nâu đỏ nhạt dần, tức là cân bằng chuyển dịch theo chiều thuận (*)
Khi hạ nhiệt độ thì cân bằng chuyển dịch theo phản ứng tỏa nhiệt (**)
Kết hợp (*) và (**) => Phản ứng thuận là phản ứng tỏa nhiệt, ∆ H < 0

Đáp án A
Khi hạ nhiệt độ, cân bằng chuyển dịch theo chiều thuận => phản ứng tỏa nhiệt, ΔH < 0

Gợi Ý nhé:
Đối với loại toán này ta nên tìm cách tổ hợp từ các quá trình đã cho để loại đi các chất trung gian và được phương trình cần tính nhiệt phản ứng.
Từ các dữ kiện của bài toán ta có:
CO(NH2)2 (r) + 2HCl (k) \(\rightarrow\) COCl2 (k) + 2NH3 (k) - \(\Delta\)H3 = + 201,0 kJ
COCl2 (k) \(\rightarrow\) CO (k) + Cl2 (k) - \(\Delta\)H2 = + 112,5 kJ
CO (k) + H2O(h) \(\rightarrow\) CO2 (k) + H2 (k) \(\Delta\)H1 = - 41,3 kJ
H2O (l) \(\rightarrow\) H2O (h) \(\Delta\)H5 = 44,01 kJ
H2 (k) + Cl2 (k) \(\rightarrow\) 2HCl (k) 2. \(\Delta\)H4 = 2.(- 92,3) = - 184,6 kJ
Cộng theo từng vế các quá trình trên và loại đi các chất trung gian, ta thu được phương trình: CO(NH2)2 (r) + H2O (l) \(\rightarrow\) CO2 (k) + 2NH3 (k) có nhiệt của phản ứng là DH = (- \(\Delta\)3) + (- \(\Delta\)H2) + \(\Delta\)H1 + \(\Delta\)H5 + 2. \(\Delta\)H4. Thay số có \(\Delta\)H = 131,61 kJ.

Khi đung nóng ống nghiệm đựng KMnO4 ( thuốc tím), nhiệt của ngọn lửa làm cho KMnO4 bị nhiệt phân. Phản ứng đốt cháy cồn (trong đèn cồn – cung cấp nhiệt) là phản ứng tỏa nhiệt, phản ứng nhiệt phân KMnO4 là phản ứng thu nhiệt.

A. Bất cứ phản ứng nào cũng phải đạt đến trạng thái cân bằng hóa học.
B. Khi phản ứng thuận nghịch ở trạng thái cân bằng thì phản ứng dừng lại.
C. Chỉ có những phản ứng thuận nghịch mới có trạng thái cân bằng hóa học.
D. Ở trạng thái cân bằng, khối lượng các chất ở hai vế của phương trình phản ứng phải bằng nhau.
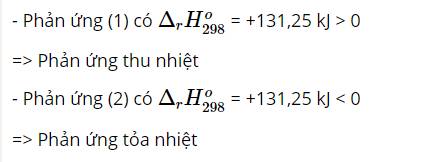

Chọn B
Hạ nhiệt độ cân bằng chuyển dịch theo chiều phản ứng tỏa nhiệt.
Theo bài ra khi hạ nhiệt độ của bình thì màu nâu đỏ nhạt dần → cân bằng chuyển dịch theo chiều thuận.
→ Phản ứng thuận tỏa nhiệt, ∆ H < 0