Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Theo thuyết A-rê-ni-ut thì:
– Axit là chất khi tan trong nước phân li ra cation H+
Ví dụ: HCl → H+ + Cl–
– Bazơ là chất khi tan trong nước phân li ra anion OH–
Ví dụ : NaOH → Na+ + OH–
– Hiđroxit lưỡng tính là hiđroxit khi tan trong nước vừa có thể phân li như axit, vừa có thể phân li như bazơ.
Zn(OH)2 ⇔ Zn2+ +20H– ; Zn(OH)2 ⇔ ZnO2-2 + 2H+
2. Những axit mà tan trong nước phân li nhiều nấc ra ion H+ gọi là các axit nhiều nấc.
Ví dụ : H2SO4, H3PO4….
Những bazơ khi tan trong nước phân li nhiều nấc ra ion OH– gọi là các bazơ nhiều nấc. Ví dụ : Mg(OH)2, Ca(OH)2,….
3. Muối là hợp chất, khi tan trong nước phân li ra cation kim loại (hoặc cation NH4+) và anion gốc axit. Ví dụ : Na2CO3 → 2Na+ + CO32-
Muối trung hòa là muối mà anion gốc axit không có khả năng phân li ra ion H+. Muối axit là muối mà anion gốc axit có khá năng phân li ra ion H+.
Sự điện li cùa muối trong nước tạo cation kim loại (hoặc NH4+ , ion phức) và anion gốc axil.

Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi
A. Các chất phản ứng phải là những chất dễ tan.
B. Các chất phản ứng phải là những chất điện li mạnh.
C. Một số ion trong dung dịch kết hợp được với nhau làm giảm nồng độ ion của chúng
D. Phản ứng không phải là thuận nghịch.

Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi
A. Các chất phản ứng phải là những chất dễ tan.
B. Các chất phản ứng phải là những chất điện li mạnh.
C. Một số ion trong dung dịch kết hợp được với nhau làm giảm nồng độ ion của chúng
D. Phản ứng không phải là thuận nghịch.

Phương trình phân tứ và ion xảy ra trong dung dịch :
a) Fe2(SO4)3 + 6NaOH → 2Fe(OH)3\(\downarrow\) + 3Na2SO4
2Fe3+ + 3SO42- + 6Na+ + 6OH- → 2Fe(OH)3\(\downarrow\)+ 6Na+ + 3SO42-
Fe3+ + 3OH- → Fe(OH)3\(\downarrow\)
b) NH4Cl + AgNO3 → NH4NO3 + AgCl↓
NH4 + Cl- + Ag+ + NO3- → NH4+ + NO3- + AgCl↓
Cl- + Ag+ → AgCl↓
c) NaF + HCl → NaCl + HF↑
Na+ + F- + H+ + Cl- → Na+ + Cl- + HF↑
F- + H+ → HF\(\uparrow\)
d) Không có phản ứng xảy ra
e) FeS(r) + 2HCl → FeCl2 + H2S ↑
FeS(r) + 2H+ + 2Cl- → Fe2+ + 2Cl- + H2S↑
FeS(r) + 2H+ \(\rightarrow\) Fe2+ + H2S↑
g) HClO + KOH \(\rightarrow\) KClO + H2O
HClO + K+ + OH- \(\rightarrow\) K+ + CIO- + H2O
HClO + OH- \(\rightarrow\) CIO- + H2O.

- Tạo thành chất kết tủa: NH4Cl + AgNO3 → NH4NO3 + AgCl\(\downarrow\)
Ag+ + cl‑ \(\rightarrow\) AgCl\(\downarrow\)
- Tạo thành chất điện li yếu: NaOH + HCl \(\rightarrow\)NaCl + H2O
H+ + OH– \(\rightarrow\) H2O
- Tạo thành chất khí: K2CO3 + 2HCl \(\rightarrow\) 2KCl + CO2\(\uparrow\) + H2O
2H+ + CO32– → CO2\(\uparrow\) + H2O
- Tạo thành chất kết tủa: NH4Cl + AgNO3 \(\rightarrow\) NH4NO3 + AgCl\(\downarrow\)
Ag+ + cl‑ → AgCl\(\downarrow\)
- Tạo thành chất điện li yếu: NaOH + HC1 \(\rightarrow\)NaCl + H2O
H+ + OH– \(\rightarrow\)H2O
- Tạo thành chất khí: K2CO3 + 2HC1 \(\rightarrow\) 2KC1 + CO2\(\uparrow\) + H2O
2H+ + CO32– \(\rightarrow\) CO2\(\uparrow\) + H2O

Phương trình ion rút gọn :
a) Ca2+ + CO32- → CaCO3 ↓
b) Fe2+ + 2OH- → Fe(OH)2↓
c) HCO3- + H+ → CO2 ↑ + H2O
d) HCO3- + OH- → H2O + CO32-
e) Không có phương trình ion rút gọn.
g) Pb(OH)2(r) + 2H+ → Pb2+ + 2H2O
h) H2PbO2(r) + 2OH- → PbO22- + 2H2O
i) Cu2+ + S2- → CuS↓.

Chọn A.
KCl rắn tồn tại dưới dạng tinh thể ion. Mạng tinh thể KCl tương tựu mạng tinh thể NaCl (hình 3.1 SGK lớp 10). Tinh thể ion rất bền vững vì lực hút tĩnh điện giữa các ion ngược dấu trong tinh thể ion rất lớn. Các ion K+ và Cl- chỉ dao động tại các đầu nút của mạng tinh thể (không chuyển dịch tự do) vì vậy, KCl rắn, khan không dẫn điện.
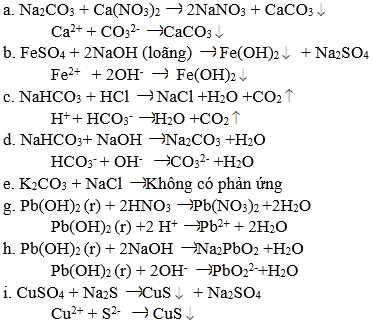
Đáp án D
(c) Sai vì dầu ăn chứa C, H và O còn mỡ bôi trơn chỉ chứa C và H.
(d) Sai vì số N luôn lớn số liên kết peptit.
(e) Sai vì có thể làm quỳ tím hóa xanh, đỏ hoặc không đổi mà.
⇒ (a), (b) và (g) đúng