Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn B
Z và T thuộc cùng nhóm VIA; Z ở chu kỳ 3; T ở chu kỳ 2 → Tính phi kim: T > Z.
X và Y thuộc cùng nhóm IA; X ở chu kỳ 4; Y ở chu kỳ 3 → Tính phi kim: Y > X
Y và Z thuộc cùng chu kỳ 3; Zy < Zz → Tính phi kim: Y < Z.
Thứ tự tăng dần tính phi kim: X < Y < Z < T.

Cấu hình tự viết nhé bạn!
X thuộc nhóm IA, chu kì 3. Y thuộc nhóm IIIA, chu kì 3. R thuộc nhóm IA, chu kì 4 và T thuộc nhóm IIA , chu kì 3.
- Tăng dần bán kính nguyên tử: R>X>T>Y
- Tăng dần năng lượng ion hoá: Y>T>X>R
- Giảm dần tính kim loại: R>X>T>Z
- Các hidroxit của chúng theo chiều bazo giảm dần: ROH > XOH > T(OH)2 > Y(OH)3

Cấu hình e của X : $1s^2 2s^2 2p^6 3s^1$
Cấu hình e của Y : $1s^2 2s^2 2p^6 3s^2 3p^2$
Cấu hình e của T : $1s^2 2s^2 2p^6 3s^2 3p^6 4s^2$
Cấu hình e của R : $1s^2 2s^2 2p^6$
Nguyên tử có nhỏ hơn hoặc bằng 3 electron lớp ngoài cùng thì là kim loại
Suy ra, chọn D

Đáp án B
ZX = 11 có cấu hình e lớp ngoài cùng là 3s1
ZY = 11 có cấu hình e lớp ngoài cùng là 3s2
ZZ = 19 có cấu hình e lớp ngoài cùng là 4s1
Trong cùng 1 nhóm tính kim loại tăng dần theo chiều tăng của điện tích hạt nhân do đó tính bazo tương ứng của X’ <Z’
Trong cùng 1 CK tính kim loại giảm dần theo chiều tăng của điện tích hạt nhân do đó tính bazo tương ứng của X’>Y’

B
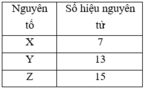
Ta có: X và Y thuộc cùng chu kỳ 3, Z X < Z Y → Tính kim loại X > Y.
X và Z thuộc cùng 1 nhóm IA; Z X < Z Z → Tính kim loại Z > X.
→ Chiều tăng dần tính kim loại là: Y < X < Z;
Chiều tăng dần tính bazơ là: Y’ < X’ < Z’.