THÔNG BÁO VỀ CUỘC THI HÓA HỌC
Vòng 3 của cuộc thi hóa học đã chính thức khép lại. Sau đây thì cô sẽ công bố đáp án của vòng 3.
ĐÁP ÁN
Câu 1: Hoàn thành chuỗi phản ứng sau
a. S → SO2 → SO3 → H2SO4 → Na2SO4 → BaSO4
b. MnO2 → Cl2 → HCl → NaCl → NaOH → NaClO
a. (1) S + O2 \(\underrightarrow{t^o}\)SO2
(2) 2SO2 + O2 \(\underrightarrow{t^o,p,V_2O_5}\) 2SO3
(3) SO3 + H2O → H2SO4
(4) H2SO4 + NaOH → Na2SO4 + H2O
(5) Na2SO4 + Ba(OH)2 → BaSO4↓ + 2NaOH
b. (1) MnO2 + 4HCl đặc 2\(\underrightarrow{t^o}\)MnCl2 + Cl2↑ + 2H2O
(2) Cl2 + H2 \(\underrightarrow{t^o}\)2HCl↑
(3) HCl + NaOH → NaCl + H2O
(4) 2NaCl + H2O \(\underrightarrow{đpmn}\)NaOH + H2↑ + Cl2↑
(5) 2NaOH + Cl2 → NaCl + NaClO + H2O
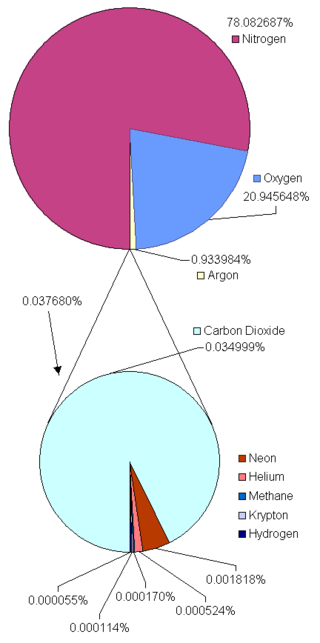
Câu 2: “Không khí” là một hỗn hợp chứa rất nhiều chất khí với thành phần chủ yếu là khí nitơ, oxi, cacbonic, argon,…Theo kết quả phân tích của NASA thành phần % về thể tích của các khí trong không khí là như sau:
 |
Nitrogen: N2 (MN2=28)
Oxygen: O2 (MO2=32)
Argon: Ar ( MAr=40)
Carbon Dioxide: CO2 (MCO2=44)
Neon: Ne
Helium : He
Methane: CH4
Krypton: Kr
Hydrogen: H2
|
Dựa vào biểu đồ do NASA nghiên cứu, chúng ta thấy rằng, thành phần chính của không khí chủ yếu là khí nitơ, khí oxi, khí argon và khí cacbonic. Dựa vào các số liệu % về thể tích bốn khí đã cho ở trên, hãy tính gần chính xác giá trị khối lượng mol trung bình của không khí. Giải thích tại sao giá trị khối lượng mol trung bình của không khí thường được sử dụng là 29 (g/mol).
Dựa vào biểu đồ ta có thành phần % về thể tích của các khí nitơ, oxi, argon, cacbonic lần lượt là:
| Khí |
N2 |
O2 |
Ar |
CO2 |
| % |
78,082687 |
20,945648 |
0,933984 |
0,034999 |
Khối lượng mol trung bình chính xác của không khí là
\(\overline{M_{kk}}=\%N_2.28+\%O_2.32+\%Ar.40+\%CO_2.44=28,95475\)
Giá trị khối lượng mol trung bình của không khí thường được sử dụng là 29 (g/mol) vì nó rất gần với giá trị tính toán chính xác.
Câu 3: Chỉ sử dụng thuốc thử là dung dịch phenolphthalein hãy đề xuất cách nhận biết 4 dung dịch mất nhãn sau: NaOH, H2SO4, Na2SO4, BaCl2.
- Trích mẫu thử các dung dịch vào các ống nghiệm, nhỏ một giọt phenolphtalein vào mỗi ống nghiệm.
+ Dung dịch chuyển màu hồng : NaOH.
+ Dung dịch không đổi màu : H2SO4, Na2SO4, BaCl2.
- Trích mẫu thử 3 dung dịch H2SO4, Na2SO4, BaCl2 cho vào 3 ống nghiệm riêng biệt, nhỏ vào mỗi ống nghiệm một giọt phenolphtalein, sau đó cho vào mỗi ống nghiệm một giọt dung dịch NaOH.
+ Dung dịch chuyển màu hồng: Na2SO4, BaCl2.
+ Dung dịch không đổi màu : H2SO4.
2NaOH + H2SO4 → Na2SO4 + H2O
- Trích mẫu thử 2 dung dịch Na2SO4, BaCl2 vào các ống nghiệm, sau đó cho tác dụng với dung dịch H2SO4.
+ Xuất hiện kết tủa trắng : BaCl2.
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
+ Không xẩy ra hiện tượng gì : Na2SO4.
Câu 4: Hòa tan 0,575g kim loại Na vào 200ml dung dịch H2SO4 0,05M thì thu được dung dịch X và V lít khí H2(đktc).
a. Xác định giá trị V và tính nồng độ mol của các chất tan có trong dung dịch X sau phản ứng. Coi như thể tích dung dịch không thay đổi sau phản ứng.
b. Nhỏ từ từ đến dư dung dịch Ba(HCO3)2 vào dung dịch X. Tính khối lượng kết tủa cực đại thu được sau phản ứng.
a.
\(n_{Na}=0,025mol;n_{H2SO4}=0,02mol.\)
Vì \(\dfrac{n_{Na}}{2}>\dfrac{n_{H2SO4}}{1}\) ⇒ Sau khi phản ứng với axit, Na còn dư. Kim loại Na dư sẽ tiếp tục phản ứng với nước.
PTHH:
2Na + H2SO4 loãng → Na2SO4 + H2↑
0,02......0,01....................0,01......0,01
2Na + 2H2O → 2NaOH + H2↑
0,005....0,005.......0,005.....0,0025
\(\Rightarrow V_{H2}=22,4.\left(0,01+0,0025\right)=0,28lit\)
Sau phản ứng, coi như thể tích dung dịch không thay đổi.
\(\Rightarrow C_{M\left(Na2SO4\right)}=\dfrac{0,01}{0,2}=0,05M\)
\(\Rightarrow C_{M\left(NaOH\right)}=\dfrac{0,005}{0,2}0,025M\)
b. Khi nhỏ từ từ dung dịch Ba(HCO3)2 từ từ đến dư vào dung dịch X (gồm Na2SO4 và NaOH) xẩy ra các phản ứng như sau:
Ba(HCO3)2 + 2NaOH → BaCO3↓ + Na2CO3 + H2O
0,0025.............0,005..........0,0025........0,0025
Ba(HCO3)2 + Na2SO4 → BaSO4↓ + NaHCO3
0,01....................0,01...........0,01..........0,01
Ba(HCO3)2 + Na2CO3 → BaCO3↓ + NaHCO3
0,0025.............0,0025........0,0025........0,0025
Sau khi phản ứng hoàn toàn, kết tủa thu được gồm BaSO4 và BaCO3.
\(\Rightarrow m_{\downarrow}=m_{BaSO4}+m_{BaCO3}=3,315g\)
Câu 5: Một oxit kim loại có công thức là MxOy, trong đó M chiếm 72,41% khối lượng. Khử hoàn toàn oxit này bằng khí CO thu được 16,8g kim loại M. Hòa tan lượng 16,8g kim loại M bằng H2SO4 đặc nóng thu được muối M hóa trị III và 10,08 lít khí SO2(đktc) là sản phẩm khử duy nhất.
a.Viết các phương trình phản ứng đã xẩy ra dưới dạng tổng quát
b.Xác định công thức hóa học của oxit MxOy.
a. PTHH:
MxOy + yCO \(\underrightarrow{t^o}\) xM + yCO2↑
2M + 6H2SO4 đặc, nóng → M2(SO4)3 + 3SO2↑ + 6H2O
b.
2M + 6H2SO4 đặc, nóng → M2(SO4)3 + 3SO2↑ + 6H2O
0,3.......0,9...............................0,15...........0,45......0,9
\(\Rightarrow M_M=\dfrac{16,8}{0,3}=56\), suy ra M là Fe.
Công thức oxit là FexOy.
Vì trong oxit kim loại Fe chiếm 72,41% khối lượng nên oxi chiếm 27,59% về khối lượng.
\(\Rightarrow\left\{{}\begin{matrix}56x=72,41\%\left(56x+16y\right)\\16y=27,59\%\left(56x+16y\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}x=3\\y=4\end{matrix}\right.\)
Vậy oxit là Fe3O4.
HẾT.
(Không bắt buộc các bạn phải làm giống như đáp án, sử dụng cách làm khác vẫn được điểm tối đa)
P/s: Những bạn nào đã đổi tên nick trong quá trình diễn ra cuộc thi thì nhớ cmt "Tên nick cũ-Tên nick mới" để cô còn tổng hợp điểm cho các bạn. Những bạn có tổng điểm cao nhất sẽ được nhận các phần thưởng từ cuộc thi.





X tan trong nước tạo dd đồng nhất và có phản ứng với NaHCO3 sinh ra khí CO2 => X là axit axetic
CH3COOH + NaHCO3→ CH3COONa + H2O + CO2↑
Y tan trong nước và tạo kết tủa Ag với Ag2O trong NH3 dư => Y là đường glucozơ: C12H22O11
C6H10O2 (dd) + Ag2O (dd phức) → N H 3 C6H12O7 ( axit gluconic) (dd)+ 2Ag↓
Z tan trong nước, bị thủy phân trong H2SO4, sau đó cho phản ứng tráng bạc với Ag2O trong NH3 => Z là saccarozơ
C12H22O11 + H2O → H 2 S O 4 , t ∘ C6H12O6 (glucozơ) + C6H12O6 ( fructozơ)
C6H12O6 (glucozơ) + Ag2O (dd phức) → N H 3 C6H12O7 ( axit gluconic) (dd)+ 2Ag↓
P không tan trong nước, tạo thành hai lớp chất lỏng không trộn lẫn => P là dầu thực vật
Q tan trong nước tạo thành dung dịch đồng nhất => Q là ancol etylic (C2H5OH)