K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.
Các câu hỏi dưới đây có thể giống với câu hỏi trên

5 tháng 11 2019
Đáp án A.
Sử dụng yếu tố diện tích tiếp xúc, diện tích tiếp xúc càng lớn, thời gian càng nhỏ.

23 tháng 12 2017
2Al + 3H2SO4 -> Al2(SO4)3 + 3H2
nAl=0,2(mol)
Theo PTHH ta có:
nH2=nH2SO4=\(\dfrac{3}{2}\)nAl=0,3(mol)
mH2SO4=98.0,3=29,4(g)
VH2=22,4.0,3=6,72(lít)
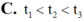


Chọn đáp án A
Tốc độ tỉ lệ với bề mặt chất rắn → Đá vôi tan nhanh : (3) > (2) > (1)