Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nNO = 2,25/22,4 = 0,1 (mol)
PTHH: R + 4HNO3 -> R(NO3)3 + NO + 2H2O
nR = nR(NO3)3 = nNO = 0,1 (mol)
MR = 2,7/0,1 = 27 (g/mol)
<=> R là nhôm (Al)
Muối thu được: Al(NO3)3
mAl(NO3)3 = 0,1 . 213 = 21,3 (g)

a) Gọi số mol Cu, Pb là a, b (mol)
=> 64a + 207b = 14,34 (1)
\(n_{NO}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\)
Cu0 - 2e --> Cu+2
a-->2a
Pb0 - 2e --> Pb+2
b-->2b
N+5 +3e --> N+2
0,18<--0,06
Bảo toàn e: 2a + 2b = 0,18 (2)
(1)(2) => a = 0,03; b = 0,06
=> \(\left\{{}\begin{matrix}\%m_{Cu}==\dfrac{0,03.64}{14,34}.100\%=13,39\%\\\%m_{Pb}=\dfrac{0,06.207}{14,34}.100\%=86,61\%\end{matrix}\right.\)
b)
\(\left\{{}\begin{matrix}n_{Cu\left(NO_3\right)_2}=0,03\left(mol\right)\\n_{Pb\left(NO_3\right)_2}=0,06\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}m_{Cu\left(NO_3\right)_2}=0,03.188=5,64\left(g\right)\\m_{Pb\left(NO_3\right)_2}=0,06.331=19,86\left(g\right)\end{matrix}\right.\)

Đáp án D
Dung dịch B mất màu hoàn toàn => Cu2+ phản ứng hết
3 kim loại là Ag, Cu, Fe dư.
mFe dư =55,2-108.0,4-64.0,1=5,6 gam
Đặt số mol Mg và Fe phản ứng lần lượt là x, y
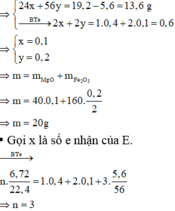
=> Khí E là NO

a) Gọi số mol Fe, Cr là a, b (mol)
=> 56a + 52b = 10,8 (1)
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
a---->a------------------->a
Cr + H2SO4 --> CrSO4 + H2
b--->b------------------->b
=> a + b = 0,2 (2)
(1)(2) => a = 0,1 (mol); b = 0,1 (mol)
=> \(\left\{{}\begin{matrix}\%Fe=\dfrac{0,1.56}{10,8}.100\%=51,85\%\\\%Cr=\dfrac{0,1.52}{10,8}.100\%=48,15\%\end{matrix}\right.\)
b) \(n_{H_2SO_4}=a+b=0,2\left(mol\right)\)
=> \(m_{H_2SO_4}=0,2.98=19,6\left(g\right)\)

\(n_{SO_2}=\dfrac{2,24}{22,4}=0,1mol\)
Gọi \(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{Cu}=y\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}24x+64y=4,4\\BTe:2x+2y=2n_{SO_2}=2\cdot0,1=0,2\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,05\\y=0,05\end{matrix}\right.\)
\(m_{Mg}=0,05\cdot24=1,2g\)
\(m_{Cu}=0,05\cdot64=3,2g\)
\(n_{H_2SO_4}=2n_{Mg}+2n_{Cu}=2\cdot0,05+2\cdot0,05=0,2mol\)
\(m_{H_2SO_4}=0,2\cdot98=19,6g\)

Ta có: \(n_{NO_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Theo đề bài: \(108n_{Ag}+64n_{Cu}=2,36\) (1)
Bảo toàn electron: \(n_{Ag}+2n_{Cu}=n_{NO_2}=0,05\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Ag}=0,01\left(mol\right)\\n_{Cu}=0,02\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Ag}=\dfrac{108\cdot0,01}{2,36}\cdot100\%\approx45,76\%\\\%m_{Cu}=54,24\%\end{matrix}\right.\)
Ag + 2HNO3 ⟶ AgNO3 + H2O + NO2
Cu + 4HNO3 → Cu(NO3)2 + 2NO2↑ + 2H2O
\(n_{NO_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Gọi x,y lần lượt là số mol Ag, Cu
Ta có : \(\left\{{}\begin{matrix}108x+64y=2,36\\x+2y=0,05\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}x=0,01\\y=0,02\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}m_{Ag}=0,01.108=1,08\left(g\right)\\m_{Cu}=0,02.64=1,28\left(g\right)\end{matrix}\right.\)
=> \(\%m_{Ag}=\dfrac{1,08}{2,36}.100=45,76\%\)
=>%mCu = 100 - 45,76 =54,24%
nNO = 2,24/22,4 = 0,1 (mol)
PTHH: 3R + 8HNO3 (loãng) -> 3R(NO3)2 + 2NO + 4H2O
nR(NO3)2 = nR = 3/2 . 0,1 = 0,15 (mol)
M(R) = 9,6/0,15 = 64 (g/mol)
=> R là Cu
mCu(NO3)2 = 0,15 . 188 = 28,2 (g)