Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nNa= 4,6/23=0,2(mol)
PTHH: Na + H2O ->NaOH + 1/2 H2
nNaOH=nNa=0,2(mol)
VddNaOH=V(H2O)= 100(ml)=0,1(l)
=> CMddNaOH= 0,2/0,1= 2(M)

a) $C_2H_5OH + 3O_2 \xrightarrow{t^o} 2CO_2 + 3H_2O$
b) $n_{C_2H_5OH} = \dfrac{9,2}{46} = 0,2(mol)$
Theo PTHH :
$n_{CO_2} = 2n_{C_2H_5OH} = 0,4(mol) \Rightarrow V_{CO_2} = 0,4.22,4 = 8,96(lít)$
$n_{H_2O} = 3n_{C_2H_5OH} = 0,6(mol) \Rightarrow m_{H_2O} = 0,6.18 = 10,8(gam)$
c) $CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O$
$n_{CaCO_3} = n_{CO_2} = 0,4(mol)$
$m_{CaCO_3} = 0,4.100 = 40(gam)$

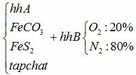
a) Gọi số mol của FeCO3: x (mol) ;
số mol của FeS2: y (mol)
4FeCO3 + O2 → Fe2O3 + 4CO2↑
x → 0,25x → x (mol)
4FeS2 +11O2 → 2Fe2O3 + 8SO2↑
y → 2,75y → 2y (mol)
∑ nO2 = 0,25x + 2,75y (mol)
Cùng điều kiện về nhiệt độ và áp suất nên tỉ lệ về thể tích = tỉ lệ về số mol
=> nN2 = 4nO2 = 4(0,25x + 2,75y)
=> nN2 = x + 11y (mol)
Vậy hỗn hợp Y gồm:
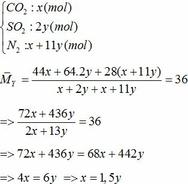
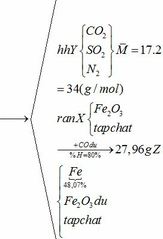
Khối lượng Fe có trong Z là:
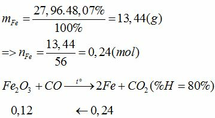
Vì H = 80% => nFe2O3 (trong X) = 0,12. 100% : 80% = 0,15 (mol)
nFe2O3 dư (trong Z) = 0,15 – 0,12 = 0,03 (mol)
Khối lượng tạp chất trong Z = 27,96 – mFe – mFe2O3 dư = 27,96 – 0,24.56 – 0,03.160 = 9,72 (g)
Bảo toàn nguyên tố Fe => nFeCO3 + nFeS2 = 2nFe2O3(trong X)
=> x + y = 0,3 (2)
Từ (1) và (2) => x = 0,18 và y = 0,12 (mol)
Áp dụng công thức PV = nRT ( với n = nCO2 + nSO2 + nN2 = 0,18 + 2. 0,12 + 0,18 +11.0,12 = 1,92)
=> P.10 = 1,92.0,082. (136,5 +273)
=> P = 6,447 ( atm) ≈ 6,5 (atm)
Ta có: mA = mFeCO3 + mFeS2 + mtạp chất = 0,18.116 + 0,12.120 + 9,72 = 45 (g)
![]()
b) hỗn hợp Y gồm:
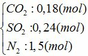
Cho hỗn hợp Y qua O2 ( xúc tác V2O5 ) có phản ứng sau:
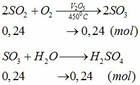
Khối lượng dd sau: mdd sau = mSO3 + mH2O = 0,24. 80 + 592,8 = 612 (g)
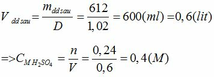

\(n_{BaCl_2}=\dfrac{208.15\%}{208}=0,15\left(mol\right)\\ n_{H_2SO_4}=\dfrac{150.19,6\%}{98}=0,3\left(mol\right)\\ BaCl_2+H_2SO_4\rightarrow BaSO_4\downarrow+2HCl\\ Vì:\dfrac{0,15}{1}< \dfrac{0,3}{1}\Rightarrow H_2SO_4dư\\ n_{H_2SO_4\left(p.ứ\right)}=n_{BaSO_4}=n_{BaCl_2}=0,15\left(mol\right)\\ n_{HCl}=2.0,15=0,3\left(mol\right)\\ n_{H_2SO_4\left(dư\right)}=0,13-0,15=0,15\left(mol\right)\\ m_{HCl}=0,3.36,5=10,95\left(g\right)\\ m_{BaSO_4}=233.0,15=34,95\left(g\right)\\ m_{H_2SO_4\left(dư\right)}=0,15.98=14,7\left(g\right)\\ m_{ddsau}=208+150-34,95=323,05\left(g\right)\\ C\%_{ddHCl}=\dfrac{10,95}{323,05}.100\approx3,39\%\)
\(C\%_{ddH_2SO_4\left(dư\right)}=\dfrac{14,7}{323,05}.100\approx4,55\%\)

\(n_{Cu}=\dfrac{32}{64}=0,5\left(mol\right);n_{O_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\ PTHH:2Cu+O_2\rightarrow2CuO\\ TL:....2.....1.....2\\ BR:....0,2......0,1.....0,2\left(mol\right)\)
Vì \(\dfrac{n_{Cu}}{2}>\dfrac{n_{O_2}}{1}\) nên sau p/ứ Cu dư, O2 hết
\(a,m_{CuO}=0,2\cdot80=16\left(g\right)\)
\(m_{HCl}=\dfrac{200\cdot14,6\%}{100\%}=29,2\left(g\right)\\ \Rightarrow n_{HCl}=\dfrac{29,2}{36,5}=0,8\left(mol\right)\\ PTHH:CuO+2HCl\rightarrow CuCl_2+H_2O\\ TL:....1.....2.....1.....1\\ BR:....0,2.....0,4.....0,2.....0,2\left(mol\right)\)
Vì \(\dfrac{n_{CuO}}{1}< \dfrac{n_{HCl}}{2}\) nên sau p/ứ HCl dư, CuO hết
\(\Rightarrow n_{HCl\left(dư\right)}=0,8-0,4=0,4\left(mol\right)\\ \Rightarrow m_{HCl\left(dư\right)}=14,6\left(g\right)\)
\(m_{CuCl_2}=0,2\cdot135=27\left(g\right)\\ m_{HCl}=0,4\cdot36,5=14,6\left(g\right)\\ m_{CuO}=16\left(g\right)\\ m_{H_2O}=0,2\cdot18=3,6\left(g\right)\\ \Rightarrow m_{dd_{CuCl_2}}=16+14,6-3,6=27\left(g\right)\)
Vậy \(C\%_{dd_{CuCl_2}}=\dfrac{27}{200}\cdot100\%=13,5\%\)

\(m_{CH_3COOH}=24\%.150=36\left(g\right)\\ \rightarrow n_{CH_3COOH}=\dfrac{36}{60}=0,6\left(mol\right)\)
PTHH: 2CH3COOH + Na2CO3 ---> 2CH3COONa + CO2 + H2O
0,6 0,3 0,6 0,3
=> VCO2 = 0,3.22,4 = 6,72 (l)
\(m_{Na_2CO_3}=0,3.31,8\left(g\right)\)
=> \(m_{ddNa_2CO_3}=\dfrac{31,8}{21,2\%}=150\left(g\right)\)
mCO2 = 0,3.44 = 13,2 (g)
\(m_{dd}=150+150-13,2=286,8\left(g\right)\)
\(m_{CH_3COONa}=0,3.82=24,6\left(g\right)\\ \rightarrow C\%_{CH_3COONa}=\dfrac{24,6}{286,8}=8,58\%\)
nNa= 9,2/23= 0,4(mol)
PTHH: 2 Na + 2 H2O -> 2 NaOH + H2
Ta có: nH2= 1/2. nNa= 1/2 . 0,4=0,2(mol)
=>V(H2,đktc)=0,2 x 22,4= 4,48(l)
Ta có: nNaOH=nNa= 0,4(mol)
=> mNaOH= 0,4.40=16(g); mH2=0,2.2=0,4(g)
mddNaOH= 9,2+100 - 0,4= 108,8(g)
=>C%ddNaOH= (16/108,8).100=14,706%
Số mol của natri
nNa = \(\dfrac{m_{Na}}{M_{Na}}=\dfrac{9,2}{23}=0,4\left(mol\right)\)
Pt : 2Na + 2H2O → 2NaOH + H2\(|\)
2 2 2 1
0,4 0,2 0,2
Số mol của khí hidro
nH2 = \(\dfrac{0,4.1}{2}=0,2\left(mol\right)\)
Thể tích của khí hidro
VH2 = nH2 . 22,4
= 0,2 . 22,4
= 4,48 (l)
Số mol của natri hidroxit
nNaOH = \(\dfrac{0,4.2}{2}=0,2\left(mol\right)\)
Khối lượng của natri hidroxit
mNaOH = nNaOH . MNaOH
= 0,2. 40
= 8 (g)
Khối lượng của dung dịch sau phản ứng mdung dịch sau phản ứng = mNa + mH2O - mH2
= 9,2 + 100 - (0,2. 2)
= 108,8 (g) Nồng độ phần trăm của dung dịch natri hidroxit
C0/0NaOH = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{8.100}{108,8}=7,35\)0/0
Chúc bạn học tốt