K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.
Các câu hỏi dưới đây có thể giống với câu hỏi trên

18 tháng 10 2018
Đáp án A
%mO/X = 86,3×0,1947 = 16,8 gam.
⇒ nO = 1,05 ⇒ nAl2O3 = 0,35 mol.
Ta có ∑nOH– = 2nH2 = 1,2 mol.
⇒ Dung dịch Y chứa:
nAlO2– = nAl/Al2O3 = 0,7 mol
& nOH dư = 0,5 mol.
+ Sau phản ứng trung hòa:
nH+ = 3,2×0,75 – 0,5 = 1,9 mol
⇒ nAl(OH)3 = 0,7 – 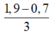 = 0,3 mol
= 0,3 mol
+ Cho 0,3 mol Al(OH)3 phản ứng
với KOH ta có phản ứng:
Al(OH)3 + KOH → KAlO2 + 2H2O
⇒ nKOHcần dùng = 0,3.
⇒ VKOH = 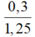 = 0,24 lít = 240 ml
= 0,24 lít = 240 ml

29 tháng 11 2017

| GIẢI THÍCH THÊM |
| Số mol điện tích dương n+ mà tôi gọi trong lời giải thích là điện tích dương ứng với Na, K, Ba ta suy ra từ số mol H2. |

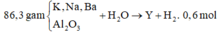

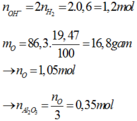
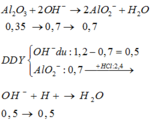
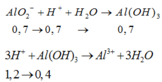
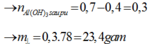
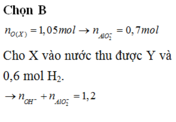




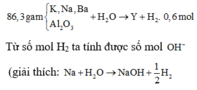

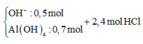

Ta có n O = 3n Al2O3 = 86,3. 19,46697567 /(100.16)= 1,05 mol
=>nAl2O3 =0,35 mol
Khi phản ứng với nước ta có dạng tổng quát: M + xH2O → M(OH)x + 0,5x H2
=> n OH =2 n H2 = 0,6 mol.2 = 1,2 mol
Al2O3 + 2OH- → 2AlO2- + 2H2O
=> Sau phản ứng thì n OH dư = 0,5 mol và n AlO2- = 0,7 mol
Khi cho 2,4 mol HCl thì
H+ + OH- → H2O
H+ +AlO2- + H2O → Al(OH)3
Al(OH)3 + 3 H+ → Al3+ + 3H2O
=> n Al(OH)3 =0,3 mol => m=0,3.78 = 23,4g
=>C