

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



$2Al + 2H_2O + 2NaOH \to 2NaAlO_2 + 3H_2$
$n_{Al} = \dfrac{2}{3}n_{H_2} = \dfrac{2}{3}. \dfrac{6,72}{22,4} = 0,2(mol)$
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
$Mg + 2HCl \to MgCl_2 + H_2$
$n_{H_2} = \dfrac{3}{2}n_{Al} +n_{Mg}$
$\Rightarrow n_{Mg} = \dfrac{8,96}{22,4} - 0,2.\dfrac{3}{2} = 0,1(mol)$
Suy ra :
$m_{Mg} = 0,1.24 = 2,4(gam) ; m_{Al} = 0,2.27 = 5,4(gam)$

Gọi x, y (mol) lần lượt là số mol Mg, Al trong hỗn hợp.
Phương trình phản ứng:
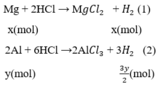
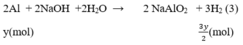
Số mol H2
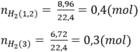
Theo bài ra ta có hệ phương trình:
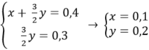
mMg = 24.0,1 = 2,4(g)
mAl = 27.0,2 = 5,4(g)

- Xét TN2:
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: 2Al + 2NaOH + 2H2O --> 2NaAlO2 + 3H2
0,2<--------------------------------0,3
=> mAl = 0,2.27 = 5,4 (g)
- Xét TN1:
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
0,2------------------->0,3
Mg + 2HCl --> MgCl2 + H2
0,15<------------------0,15
=> mMg = 0,15.24 = 3,6 (g)

Gọi hóa trị của M là n
Gọi nMg = x mol ⇒ nFe = 3.x mol
Số mol H2 là: nH2 = 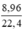 = 0,4 (mol)
= 0,4 (mol)
Số mol Cl2 là: nCl2 = 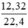 = 0,55 (mol)
= 0,55 (mol)
Các PTHH
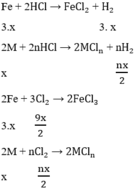
Theo bài ra ta có hệ phương trình:
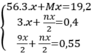
Giải hệ pt ⇒ x = 0,1 mol ⇒ n = 2 ⇒ M = 24
Vậy M là Mg
nMg = 0,1 mol ⇒ nFe = 0,3 mol
Thành phần % theo khối lượng
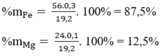

1. Gọi chung hh 2 KL trên là A.
BT e, có: nA = 2nH2 ⇒ nH2 = 0,05 (mol)
⇒ VH2 = 0,05.22,4 = 1,12 (l)
2. Ta có: \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
BT e, có: 3nAl = 2nH2 ⇒ nAl = 0,1 (mol)
\(\Rightarrow m_{Al_2O_3}=7,8-m_{Al}=5,1\left(g\right)\)
\(\Rightarrow\%m_{Al_2O_3}=\dfrac{5,1}{7,8}.100\%\approx65,38\%\)

Ta có: \(n_{H_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\) \(\Rightarrow m_{H_2}=0,35\cdot2=0,7\left(g\right)\)
Bảo toàn nguyên tố: \(n_{HCl}=2n_{H_2}=0,7\left(mol\right)\)
\(\Rightarrow m_{HCl}=0,7\cdot36,5=25,55\left(g\right)\)
Bảo toàn khối lượng: \(m_{muối}=m_{KL}+m_{HCl}-m_{H_2}=34,55\left(g\right)\)