Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 1 :
n Mg = 4,8/24 =0,2(mol)
n H2 = 3,36/22,4 = 0,15(mol)
Y gồm 0,2 mol Mg và O
Bảo toàn electron :
2n Mg = 2n O + 2n H2
<=> n O = 0,2 - 0,15 = 0,05(mol)
\(2H^+ + O^{2-} \to H_2O\\ 2H^+ + 2e \to H_2\)
Ta có :
n H+ = 2n O + 2n H2 = 0,15.2 + 0,05.2 = 0,4(mol)
=> n H2SO4 = 1/2 nH+ = 0,2(mol)
=> V dd H2SO4 = 0,2/1 = 0,2(lít)
Câu 2 :
Oleum : H2SO4.nSO3
n NaOH = 0,2.0,15 = 0,03(mol)
2NaOH + H2SO4 $\to$ Na2SO4 + 2H2O
n H2SO4 = 1/2 n NaOH = 0,015(mol)
=> trong 200 ml dung dịch X chứa 0,015.2 = 0,03(mol) H2SO4
H2SO4.nSO3 + nH2O $\to$ (n + 1)H2SO4
Theo PTHH :
\(n_{oleum} = \dfrac{n_{H_2SO_4}}{n + 1}\\ \Rightarrow 0,015 = \dfrac{0,03}{n + 1}\\ \Rightarrow n = 1\)
Vậy oleum cần tìm là H2SO4.SO3

a.\(Fe+S\rightarrow\left(t^o\right)FeS\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(FeS+2HCl\rightarrow FeCl_2+H_2S\)
b.\(n_{hhk}=\dfrac{4,48}{22,4}=0,2mol\)
\(Fe+S\rightarrow\left(t^o\right)FeS\)
Ta thu được hh khí --> S hết, Fe dư
Gọi \(\left\{{}\begin{matrix}n_{Fe}=x\\n_S=y\end{matrix}\right.\)
\(\rightarrow n_{FeS}=n_{Fe}=n_S\rightarrow n_{Fe\left(dư\right)}=x-y\) ( mol )
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(x-y\) \(x-y\) ( mol )
\(FeS+2HCl\rightarrow FeCl_2+H_2S\)
y y ( mol )
Ta có: \(\left(x-y\right)+y=0,2\)
\(\Leftrightarrow x=0,2\)
Ta có:\(56x+32y=14,4\)
\(\Leftrightarrow56.0,2+32y=14,4\)
\(\Leftrightarrow y=0,1\)
\(\rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,2.56}{14,4}.100=77,77\%\\\%m_S=100\%-77,77\%=22,23\%\end{matrix}\right.\)

a. ptpư:
Fe + S → FeS
0,2 <----- 0,2 <------ 0,2
FeS + 2HCl → FeCl2 + H2S
0,2 <-------------------------- 0,2
Fe + 2HCl → FeCl2 + H2
0,1 <----------------------- 0,1
H2S + 2NaOH → Na2S + 2H2O
b.
nH2 = 2,24/22,4 = 0,1 mol
nH2S = 6,72/22,4 – 0,1 = 0,2 mol
nFe = 0,3 mol; nS =0,2
mX = (0,2+0,1).56 + 0,2.32 = 23,3 gam



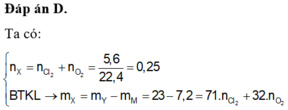
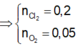

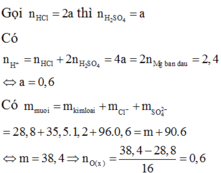
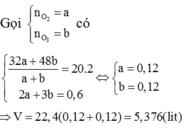
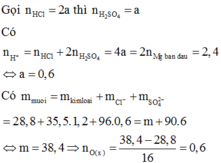
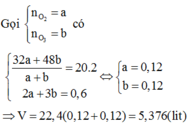
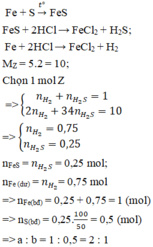
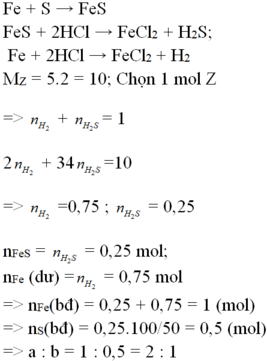
Gọi 2a và 3a lần lượt số mol của M và Mg
\(n_{Cl2}=\frac{3,36}{22,4}=0,15\left(mol\right)\)
\(n_{H2}=\frac{1,12}{22,4}=0,05\left(mol\right)\)
Quá trình xảy ra:
\(M\rightarrow ne+M+n\)
2a ___2na_____
\(Mg\rightarrow3e+Mg^{+2}\)
3a___6a_________
\(2H^++2e\rightarrow H_2\)
____0,1______0,05
\(Cl_2+2e\rightarrow2Cl^-\)
0,15__0,3____
BT e: \(2na+6a=0,1+0,3=0,4\)
\(\Leftrightarrow na+3a=0,2\)
\(\Leftrightarrow a\left(n+3\right)=0,2\left(1\right)\)
BTKL: \(2aM+3a.24=7,5\Leftrightarrow a\left(2M+72\right)=7,5\left(2\right)\)
Lấy (2) chia (1)
\(\Leftrightarrow\frac{a\left(2M+72\right)}{a\left(n+3\right)}=\frac{7,5}{0,2}\)
\(\Leftrightarrow\frac{\left(2M+71\right)}{\left(n+2\right)}=\frac{75}{2}\)
\(\Leftrightarrow\left(2M+72\right).2=75.\left(n+3\right)\)
\(\Leftrightarrow4M+144=75n+225\)
\(\Rightarrow M=\left(\frac{81+75n}{4}\right)\)
Với \(n=1\Rightarrow M=39\left(K\right)\)
Vậy kim loại M là Kali (K)