Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)Gọi x,y lần lượt là số mol của Al, Fe trong hỗn hợp ban đầu (x,y>0)
Sau phản ứng hỗn hợp muối khan gồm: \(\left\{{}\begin{matrix}AlCl_3:x\left(mol\right)\\FeCl_2:y\left(mol\right)\end{matrix}\right.\)
Ta có hệ phương trình: \(\left\{{}\begin{matrix}27x+56y=13,9\\133,5x+127y=38\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x\approx0,0896\\y\approx0,205\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,0896\cdot27\cdot100\%}{13,9}\approx17,4\%\\\%m_{Fe}=\dfrac{0,205\cdot56\cdot100\%}{13,9}\approx82,6\%\end{matrix}\right.\)
Theo Bảo toàn nguyên tố Cl, H ta có:\(n_{H_2}=\dfrac{n_{HCl}}{2}=\dfrac{3n_{AlCl_3}+2n_{FeCl_2}}{2}\\ =\dfrac{3\cdot0,0896+2\cdot0,205}{2}=0,3394mol\\ \Rightarrow V_{H_2}=0,3394\cdot22,4\approx7,6l\)

\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Ta có:
\(m_{muoi}=m_{kl}+m_{Cl^-}\)
Nên m chất rắn tăng lên là khối lượng gốc clorua nhập vào
\(m_{cr\left(tanglen\right)}=m_{Cl^-}\Rightarrow m_{Cl^-}=13,15-6,05=7,1\left(g\right)\)
\(\Rightarrow n_{Cl^-}=0,2\left(mol\right)\)
\(\Rightarrow m_{HCl}=7,3\left(g\right)\Rightarrow m=73\left(g\right)\)
Tính giá trị m nha chứ không phải tìm khối lượng HCl đã dùng ,biết lượng axit dùng dư 20% so với lượng phản ứng

1)2Al+6HCl ->2Al2Cl3+3H2
Fe+2HCl->FeCl2+H2
Gọi số mol của Al là x;Fe là y
ta có 2x*23+56y=8.3
3x+y=5.6/22.4
giải ra là xong hết bài 1 r nha

Gọi : \(\left\{{}\begin{matrix}n_{Al_2O_3}=a\left(mol\right)\\n_{Zn}=b\left(mol\right)\end{matrix}\right.\)⇒ 102a + 65b = 2,505(1)
\(Al_2O_3 + 6HCl \to 2AlCl_3 + 3H_2O\\ Zn + 2HCl \to ZnCl_2 + H_2\)
Muối gồm : \(\left\{{}\begin{matrix}AlCl_3:2a\left(mol\right)\\ZnCl_2:b\left(mol\right)\end{matrix}\right.\)⇒ 133,5.2a + 136b = 6,045(2)
Từ (1)(2) suy ra : a = 0,015 ; b = 0,015
Vậy :
\(\%m_{Al_2O_3} = \dfrac{0,015.102}{2,505}.100\% = 61,08\%\\ \%m_{Zn} = 100\% - 61,08\% = 38,92\%\)
Theo PTHH : \(n_{HCl} = 6a + 2b = 0,12(mol)\\ \Rightarrow C\%_{HCl} = \dfrac{0,12.36,5}{200}.100\% = 2,19\%\)

a) Sửa đề: dd H2SO4 9,8%
Ta có: \(n_{H_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\) \(\Rightarrow m_{H_2}=0,35\cdot2=0,7\left(g\right)\)
Bảo toàn nguyên tố: \(n_{H_2SO_4}=n_{H_2}=0,35\left(mol\right)\) \(\Rightarrow m_{ddH_2SO_4}=\dfrac{0,35\cdot98}{9,8\%}=350\left(g\right)\)
\(\Rightarrow m_{dd}=m_{KL}+m_{H_2SO_4}-m_{H_2}=361,6\left(g\right)\)
b) Tương tự câu a
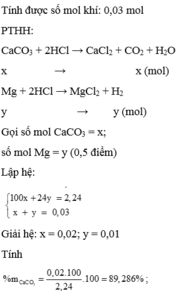
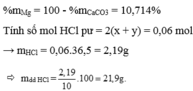
Zn+2HCl→ZnCl2+H2
2Al+6HCl→2AlCl3+3H2
Gọi số mol HCllà x
n H2=\(\dfrac{1}{2}\)n HCl=0,5x
Bảo toàn khối lượng: mkl+mHCl=mmuối+mH2
6,05+36,5x=13,15+0,5x.2
→x=0,2 mol
mHCl=0,2.36,5=7,3 gam
=>m =mddHCl=\(\dfrac{7,3}{10\%}\)=73gam