Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

QT cho e: Xét với ½ khối lượng hỗn hợp
Mg→ Mg2++ 2e (1)
x 2x mol
Al→ Al3++ 3e (2)
y 3y mol
Cu→ Cu2++ 2e (3)
z 2z mol
→ne cho= 2x+ 3y+2z mol
QT nhận e:
-Phần 1: nNO2=0,47 mol
N+5+ 1e→ NO2
0,47 0,47 mol
Theo ĐL bảo toàn e: ne cho= 2x+ 3y+2z = ne nhận= 0,47
-Phần 2:
Cl2+ 2e→ 2Cl-
0,47 0,47
Theo ĐL bảo toàn e: ne cho= 2x+ 3y+2z = ne nhận= 0,47
mmuối clorua= mkim loại+ mCl-= mkim loại+ 0,47.35,5=27,875 → mkim loại=11,19 gam → m= 11,19.2=22,38 gam

Giả sử số mol của Mg, Al trong Y lần lượt là a, b (mol)
=> 24a + 27b = 5,1
PTHH: Mg + 2HCl --> MgCl2 + H2
2Al + 6HCl --> 2AlCl3 + 3H2
=> a + 1,5b = 0,25
=> a = 0,1 ; b = 0,1
Gọi số mol Na là k (mol)
\(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
PTHH: 2Na + 2H2O --> 2NaOH + H2
k-------------------->k---->0,5k
2Al + 2NaOH + 2H2O --> 2NaAlO2 + 3H2
k<-----k------------------------------>1,5k
=> 0,5k + 1,5k = 0,4
=> k = 0,2 (mol)
=> nAl(X) = 0,2 + 0,1 = 0,3 (mol)
=> mAl(X) = 0,3.27 = 8,1 (g)

Đáp án C
Đây là một bài toán khá hay và khó về phản ứng thế halogen của ankan
Gọi ankan đã cho là CnH2n+2
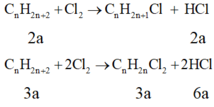
Nhận thấy dù phản ứng với tỉ lệ 1:2 hay 1:2 thì nHCl= nCl2
Nên:
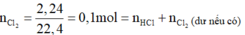
Mặt khác số mol khí Z thoát ra sau phản ứng bằng 0,15 mol > 0,1 mol nên phải có ankan dư.
Ta có: nankan dư = 0,15 - 0,1 = 0,05 mol
Ngoài ra đề bài cho biết khi Z tác dụng với dd NaOH vừa đủ thì tạo hỗn hợp muối suy ra trong Z gồm HCl, Cl2 dư và ankan dư
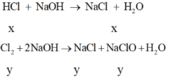
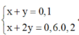
![]()
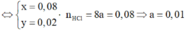
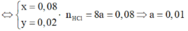
=> Số mol ankan phản ứng là 0,05 mol
Tổng số mol ankan là 0,05+0,05=0,1 mol
![]()
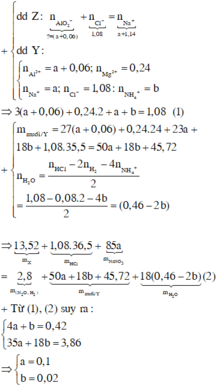
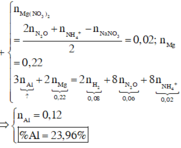

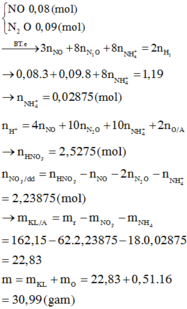
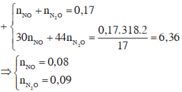
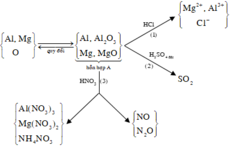


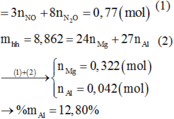
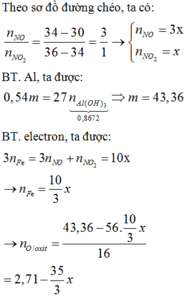
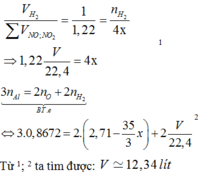
\(m_{hh.X}=16,95-7,8=9,15\left(g\right)\)
\(n_{hh.X}=\frac{5,04}{22,4}=0,225\left(mol\right)\)
Gọi số mol của Cl2 là a , số mol của O2 là b
Giải hệ PT:
\(\left\{{}\begin{matrix}71a+32b=9,16\\a+b=0,225\end{matrix}\right.\)\(\Rightarrow\left\{{}\begin{matrix}a=0,05\\b=0,175\end{matrix}\right.\)
Gọi số mol của Al là x , số mol của Mg là y
Giải hệ PT:
\(\left\{{}\begin{matrix}27x+24y=7,8\\3x+2y=4.0,175+0,05.2\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
\(\Rightarrow\%m_{Al}=\frac{0,2.27}{7,8}.100\%=69,23\%\)