
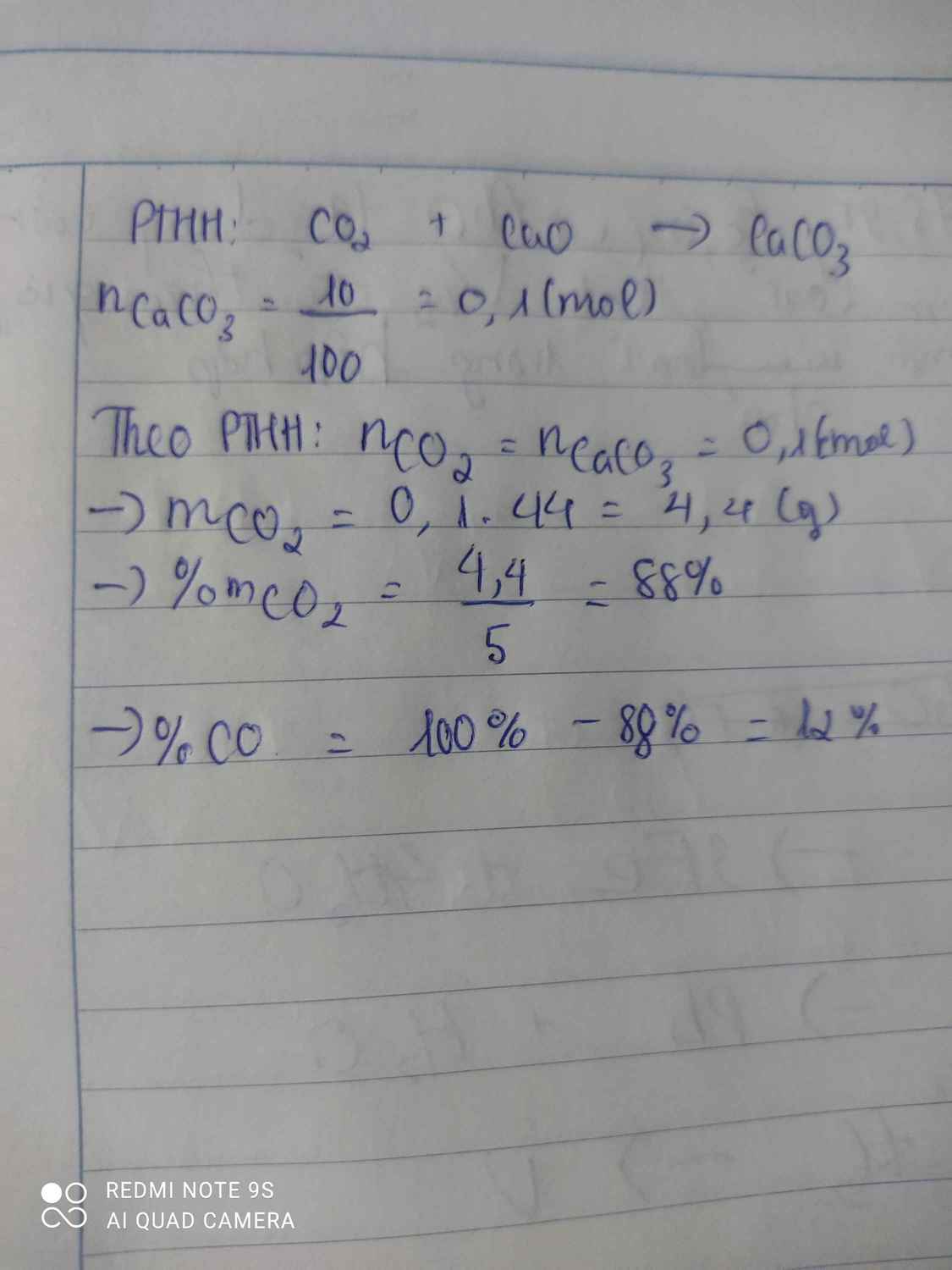
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

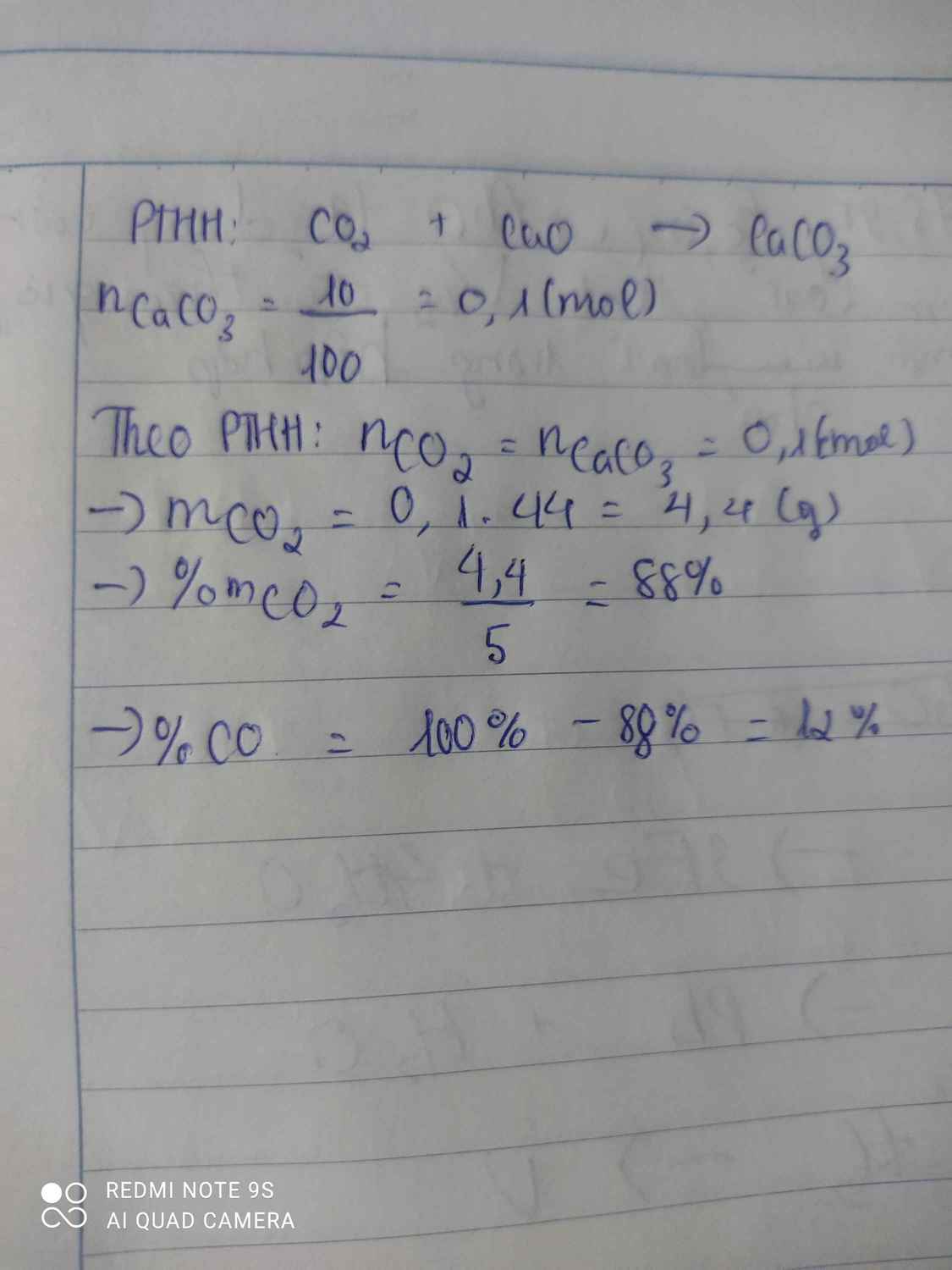

\(n_{CaCO_3}=\dfrac{15}{100}=0,15\left(mol\right)\)
PTHH:
Ca(OH)2 + CO2 ---> CaCO3↓ + H2O
0,15<-----0,15
Fe2O3 + 3CO --to--> 2Fe + 3CO2
0,05<-------------------------------0,15
=> \(\left\{{}\begin{matrix}\%m_{Fe_2O_3}=\dfrac{0,05.160}{10}.100\%=80\%\\\%m_{Al_2O_3}=100\%-80\%=20\%\end{matrix}\right.\)

\(n_{CaCO3}=\dfrac{2}{100}=0,02\left(mol\right)\)
Bảo toàn nguyên tố C: \(n_{CO}=n_{CaCO_3}=0,02\left(mol\right)\)
\(n_{Cu}=\dfrac{1,92}{64}=0,03\left(mol\right)\)
CuO + CO -------> Cu + CO2
0,02-------->0,02-->0,02
CuO + H2 -------> Cu + H2O
0,01<--------0,03-0,02=0,01
Phần trăm về thể tích cũng là phần trăm về số mol
=>\(\%V_{H_2}=\dfrac{0,01}{0,01+0,02}.100=33,33\%\)
=> %VCO=100- 33,33=66,67%
\(\%m_{H_2}=\dfrac{2.0,01}{2.0,01+44.0,02}.100=2,22\%\)
%mCO= 100-2,22=97,78%
b) \(V_{CO_2}=0,02.22,4=0,448\left(l\right)\)

Phương trình hóa học của phản ứng:
C O 2 + Ca OH 2 → Ca CO 3 + H 2 O
CuO + CO → t ° C O 2 + Cu
Theo phương trình ta có:
n CO 2 = n CaCO 3 = 5/100 = 0,05 mol
n CO = n Cu = 3,2/64 = 0,05 mol
n CaCO 3 = 5/100 = 0,05 mol
n Cu = 3,2/64 = 0,05 mol
Như vậy: n hh = 10/22,4 = 0,45 mol; n N 2 = 0,45 - 0,05 - 0,05 = 0,35 mol
% V N 2 = 0,35/0,45 x 100% = 77,78%
% V CO 2 = % V CO = 0,05/0,45 x 100% = 11,11%
Nếu cho phản ứng (2) thực hiện trước rồi mới đến phản ứng (1) thì
∑ n CO 2 = 0,05 + 0,05 = 0,1 mol
n CaCO 3 = 0,1 mol
Vậy m CaCO 3 = 0,1 x 100 = 10g

\(CuO+CO\rightarrow Cu+CO_2\)
..x..........x.........................
\(PbO+CO\rightarrow Pb+CO_2\)
..y........y........................
- Theo bài ra ta có hệ : \(\left\{{}\begin{matrix}80x+223y=3,83\\x+y=0,03\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,02\\y=0,01\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{CuO}=1,6\\m_{PbO}=2,23\end{matrix}\right.\) ( g )
b, \(n_K=n_{CO_2}=x+y=0,03\left(mol\right)\)
\(\Rightarrow V=0,672\left(l\right)\)
c, \(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3+H_2O\)
........................0,03........0,03.............
\(\Rightarrow m_{kt}=3\left(g\right)\)
Đặt \(\left\{{}\begin{matrix}n_{CuO}=x\left(mol\right)\\n_{PbO}=y\left(mol\right)\end{matrix}\right.\)
\(m_{CuO}+m_{PbO}=3,83\\ \Rightarrow80x+223y=3,83\left(1\right)\)
\(PTHH:CuO+CO\underrightarrow{t^o}Cu+CO_2\uparrow\\ \left(mol\right)......x\rightarrow..x....x.....x\\ PTHH:PbO+CO\underrightarrow{t^o}Pb+CO_2\uparrow\\ \left(mol\right)......y\rightarrow..y....y.....y\\ n_{CO}=\dfrac{0,84}{28}=0,03\\ \Rightarrow x+y=0,03\left(2\right)\)
Từ (1) và (2) ta có hpt \(\left\{{}\begin{matrix}80x+223y=3,83\\x+y=0,03\end{matrix}\right.\)
Giải hpt ta được \(\left\{{}\begin{matrix}x=0,02\\y=0,01\end{matrix}\right.\)
\(a,\left\{{}\begin{matrix}m_{CuO}=80.0,02=1,6\left(g\right)\\m_{PbO}=3,83-1,6=2,23\left(g\right)\end{matrix}\right.\)
\(b,V_{CO_2}=\left(x+y\right).22,4=\left(0,02+0,01\right).22,4=0,672\left(l\right)\)
\(c,n_{CO_2}=x+y=0,02+0,01=0,03\left(mol\right)\\ PTHH:Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3\downarrow+H_2O\\ \left(mol\right)................0,03\rightarrow0,03\\ m_{CaCO_3}=0,03.100=3\left(g\right)\)

Gọi \(\left\{{}\begin{matrix}n_{CO}=a\left(mol\right)\\n_{CH_4}=b\left(mol\right)\end{matrix}\right.\Rightarrow28a+16b=2,04\left(1\right)\)
\(n_{CaCO_3}=\dfrac{9,6}{100}=0,096\left(mol\right)\)
PTHH: \(2CO+O_2\xrightarrow[]{t^o}2CO_2\)
a------------>a
\(CH_4+2O_2\xrightarrow[]{t^o}CO_2+2H_2O\)
b---------------->b
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3\downarrow+H_2O\)
0,096<--0,096
`=> a + b = 0,096 (2)`
`(1), (2) => a = 0,042; b = 0,054`
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CO}=\dfrac{0,042}{0,042+0,054}.100\%=43,75\%\\\%V_{CH_4}=100\%-43,75\%=56,25\%\end{matrix}\right.\)

Đặt \(\left\{{}\begin{matrix}n_{Fe}=x\left(mol\right)\\n_M=y\left(mol\right)\end{matrix}\right.\) (ở mỗi phần)
Phần 1:
\(MO+CO\underrightarrow{t^o}M+CO_2\)
0,1 <------------------ 0,1
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3+H_2O\)
0,1<---------------------- 0,1
\(\left\{{}\begin{matrix}B:CO,CO_2\\C:Fe=x\left(mol\right),M=y+0,1\left(mol\right)\end{matrix}\right.\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2O\)
Còn 16 gam chất rắn không tan là kim loại M => M đứng sau H.
Và \(M\left(y+0,1\right)=16\left(g\right)\Rightarrow M=\dfrac{16}{y+0,1}\left(I\right)\)
Phần 2:
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,19<------------ 0,19
F gồm \(\left\{{}\begin{matrix}Fe_{dư}=x-0,19\left(mol\right)\\M=y+0,1\left(mol\right)\end{matrix}\right.\)
\(2Fe+6H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
(x-0,19)-------------------------> 1,5x - 0,285
\(M+2H_2SO_4\rightarrow MSO_4+SO_2+2H_2O\)
y+0,1-------------------------->y+0,1
\(\Sigma n_{SO_2}=1,5x-0,285+y+0,1=0,265\Rightarrow x=\dfrac{0,45-y}{1,5}\) (II)
Mặt khác có:
\(m_{\dfrac{A}{2}}=m_{Fe}+m_M+m_{MO}=56x+My+\left(M+16\right).0,1=28,8\left(III\right)\)
Thế (I), (II) vào (III) được:
\(56.\dfrac{0,45-y}{1,5}+\dfrac{16}{y+0,1}.y+\left(\dfrac{16}{y+0,1}+16\right).0,1=28,8\)
\(\Rightarrow y=0,15\)
\(\Rightarrow M=\dfrac{16}{y+0,1}=\dfrac{16}{0,15+0,1}=64\)
Vậy M là kim loại Cu.