

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.




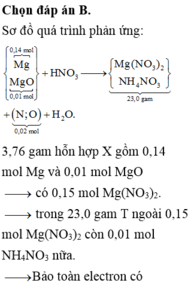
Tìm được nMg=0,14 mol và nMgO=0,01mol
--> nMg(NO3)2=0,15 ( bảo toàn Mg)
--> mMg(NO3)2=22,2
Trong T còn có NH4NO3
nNH4NO3=(23-22,2):80=0,01mol
Bảo toàn e có : 0,14.2=0,01.8+0,02.a
Tìm được a=10 --> khí là N2
Bảo toàn N --> nHNO3=0,15.2+0,01.2+0,02.2=0,36mol
Tổng số mol Mg = 0,15
=> Muối Mg(NO3)2 là 22,2 g, 0,8g còn lại là NH4NO3 (cô cạn cẩn thận)=0,01 mol =>số mol e nhận của muối này là 0.08
Tổng e cho = 0,14x2=0.28 => mol e nhận của khí là 0,2
0,2:0,02=10 => khí N2
nHNO3 dùng= 0,28 + 0,02x2 +0.01x2 +0,01x2= 0.36
Chọn D

Chọn đáp án D
gt ⇒ nFe = nMg = nCu = 0,1 mol || N2 = nNO2 ⇒ ghép: N2 + NO2 = N3O2 = N2O.NO = N2O + NO.
► Quy hỗn hợp khí về N2O và NO với số mol x và y || nkhí = x + y = 0,12 mol. HNO3 dư ⇒ Fe lên +3.
● mFe(NO3)3 + mMg(NO3)2 + mCu(NO3)2 = 0,1 × 242 + 0,1 × 148 + 0,1 × 188 = 57,8(g) < 58,8(g).
⇒ chứa muối NH4NO3 ⇒ nNH4NO3 = (58,8 - 57,8) ÷ 80 = 0,0125 mol. Bảo toàn electron:
3nFe + 2nMg + 2nCu = 8nN2O + 3nNO + 8NH4NO3 ⇒ 8x + 3y = 0,6 mol ||⇒ x = 0,048 mol; y = 0,072 mol.
► nHNO3 = 10nN2O + 4nNO + 10nNH4NO3 = 0,893 mol ⇒ chọn D.

Chọn A.
→ B T : e c h o 1 v à 2 n N H 4 N O 3 = 2 n S O 2 - 3 n N O - 8 n N 2 O 8 = 0 , 0375 m o l
Gọi T là hỗn hợp muối chứa Fe(NO3)2 và Mg(NO3)2 suy ra: m T = m Y - m N H 4 N O 3 = 126 , 4 g a m
Áp dụng phương pháp tăng giảm khối lượng + bảo toàn điện tích cho hỗn hợp T và Z ta có:
