Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn B.
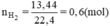
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 ↓
Al2O3 + 2NaOH → 2NaAlO2 + H2O
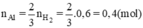
⇒ mAl = 27.0,4 = 10,8 (gam); mAl2O3 = 31,2 - 10,8 = 20,4 (gam).

Giải thích:
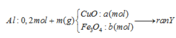
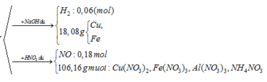
Coi trong mỗi phần có 0,2 mol Al
- Rắn Y + NaOH → 0,06 nH2
BT: e => nAl DƯ = 2/3 nH2 = 2/3. 0,06 = 0,04 ( mol)
BTNT: Al => nAl2O3 = ½ ( nAlbđ – nAl dư) = ½ ( 0,2 – 0,04) = 0,08 (mol)
BTKL: m = mFe, Cu + mO = 18,08 + 0,08.3.16 = 21,92 (g)
=> 80a + 232b = 21,92 (1)
- Rắn Y + HNO3
Sau tất cả quá trình ta có: Al → Al+3 ; Fe+8/3 → Fe+3, N+5 → N+2; N+5→ N-3
BT e ta có: 3nAl + nFe3O4 = 3nNO + 8nNH4NO3
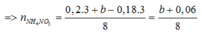
mmuối = mAl(NO3)3 + mCu(NO3)3 + mFe(NO3)3 + mNH4NO3
=>213.0,2 +188a + 242.3b + 80 ( b+0,06)/8 = 106,12 (2)
Từ (1) và (2) => a = 0,1 và b = 0,06
=> mFe3O4 = 232.2b = 232.2.0,1= 27,84 (g) ( Vì hỗn hợp ban đầu nên phải nhân đôi số liệu)
Đáp án A

Đáp án C
Các phản ứng xảy ra:
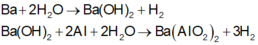
Khi cho m gam X tác dụng với dung dịch Ba (OH)2 dư thu được 20,832/2=10,416 lít H2 (đktc)
Vì thể tích H2 thu được ở hai trường hợp (khi sử dụng cùng khối lượng hỗn hợp X) khác nhau nên khi hòa tan hỗn hợp vào nước thì còn một phần kim loại Al dư không tan.
Trong m gam X gọi n Ba = a n Al = b
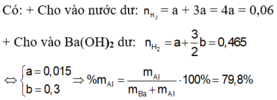

Đáp án A
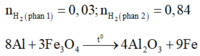
Vì phần 1 tác dụng với dung dịch NaOH có xuất hiện khí nên trong Y có Al dư.
Do đó Y gồm Fe, A12O3 và Al.

Khi cho phần 1 tác dụng với dung dịch NaOH dư có:
n Al = 2 3 n H 2 ⇒ a = 0 , 02
Khi cho phần 2 tác dụng với dung dịch HC1 dư:

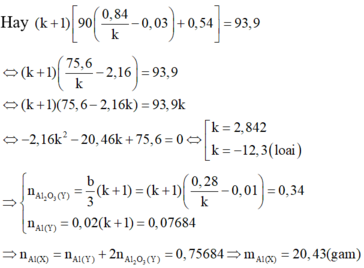
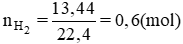
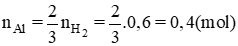
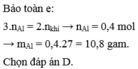
Đáp án cần chọn là: D