Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án D.
0,275 mol X phản ứng vừa đủ với 0,4 mol NaOH → 2 muối + 2 ancol
⇒ X chứa axit đơn chức và este 2 chức.
n Y + n Z = 0 , 275 m o l n Y + 2 n Z = 0 , 4 m o l ⇒ n Y = 0 , 15 m o l n Z = 0 , 125 m o l
Số mol H2O tách ra từ phản ứng ete hóa = 1 2 n a n c o l = n Z = 0 , 125 m o l
⇒ m a n c o l = 7 , 5 + 18.0 , 125 = 9 , 75 g ⇒ M ¯ a n c o l = 9 , 75 0 , 25 = 39
Mà 2 ancol có số mol bằng nhau ⇒ 2 ancol là CH3OH và C2H5OH
Trường hợp 1: Giả sử khí thu được có CTTQ là C n H 2 n + 2 − 2 k
⇒ Dẫn xuất brom là C n H 2 n + 2 − 2 k B r 2 k
⇒ % m B r = 160 k 14 n + 2 + 158 k .100 % = 85 , 106 % ⇒ 7 n + 1 = 15 k ≤ 7.5 + 1
⇒ k ≤ 2 , 4 ⇒ k = 1 , n = 2
⇒
Khí có công thức là C2H4
⇒
Y là CH2 = CHCOOH, Z là CH3OOCCH = CHCOOC2H5
⇒
m
Z
=
158.0
,
125
=
19
,
75
g

Đáp án B
nFeCl2 = nH2 = 0,1mol; nKMnO4 = 0,025 mol
Fe2+ sẽ phản ứng trước với KMnO4 / H+, mà thu được khí clo nên Fe2+ đã phản ứng hết, tiếp là Cl-
Bảo toàn e: nFe2+ + nCl- (pư) = 5.nMn+7
⇒ nCl- (pư) = 0,025 .5 – 0,1 = 0,025
nFe2+ + nCl- (pư) = 5.nMn7+ ⇒ nCl- (pư) = 0,025 .5 – 0,1 = 0,025 mol
⇒ nCl2 = 0,0125 mol ⇒ VCl2 = 0,28l

Anh đang ngoài đường không gõ latex đẹp được em thông cảm
nMg= 0,24/24= 0,01(mol)
a, Mg +2 HCl -> MgCl2 + H2
b) nH2= nMg= 0,01(mol)
V(H2,đktc)= 0,01 x 22,4= 0,224(l)
c) nHCl= 2. nMg= 2. 0,01= 0,02(mol)
=> VddHCl= 0,02/0,1= 0,2(l)

Đáp án D:
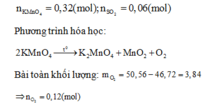
Gọi x và y lần lượt là số mol của Mg và Fe
=> 24x+56y = 9,2
Bảo toàn electron ta có
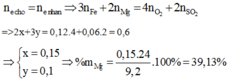

Đáp án B
B T K L : m O 2 = m K M n O 4 - m c r a n = 3 , 84 g ⇒ n O 2 = 0 , 12 m o l ⇒ n O = 0 , 24 m o l m M g , F e = m o x i t - m O = 13 , 04 - 0 , 24 . 16 = 9 , 2 g a m M g : x m o l F e : y m o l
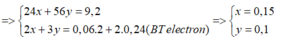
⇒ % m M g = 39 , 13 %

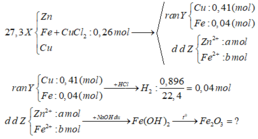
Các phản ứng xảy ra hoàn toàn, rắn Y + HCl giải phóng khí H2 => rắn Y gồm Cu và Fe dư
BT e : nFe dư = nH2 = 0,04 (mol)

Đáp án C
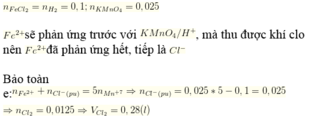


a, PT: \(MnO_2+4HCl\rightarrow MnCl_2+Cl_2+2H_2O\)
Ta có: \(n_{MnO_2}=\dfrac{30,45}{87}=0,35\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{Cl_2}=n_{MnO_2}=0,35\left(mol\right)\\n_{HCl}=4n_{MnO_2}=1,4\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{Cl_2}=0,35.71=24,85\left(g\right)\)
\(V_{ddHCl}=\dfrac{1,4}{1}=1,4\left(l\right)\)
b, PT: \(2Fe+3Cl_2\underrightarrow{t^o}2FeCl_3\)
Ta có: \(n_{Fe}=\dfrac{25,2}{56}=0,45\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,45}{2}>\dfrac{0,35}{3}\), ta được Fe dư.
Theo PT: \(n_{FeCl_3}=\dfrac{2}{3}n_{Cl_2}=\dfrac{7}{30}\left(mol\right)\)
\(\Rightarrow m_{FeCl_3}=\dfrac{7}{30}.162,5\approx37,9\left(g\right)\)
Bạn tham khảo nhé!