Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

thu được dung dịch Y chứa một chất tan và khí NO ấy. mình ghi thiếu

Đáp án B
Fe là kim loại yếu hơn Al =>Al phản ứng trước, Fe phản ứng sau => 2,4 gam kim loại chính là Fe dư
Gọi số mol các chất là Al: a mol; Fe (pứ): b mol
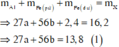
KMnO4 là chất oxi hoá mạnh, trong môi trường axit sẽ oxi hoá Fe + 2 lên Fe + 3 , Cl - 1 lên Cl 2 0 và bản thân Mn + 7 bị khử xuống Mn + 2
Như vậy, khi xét cả quá trình thì chỉ có Al, Fe và KMnO4 thay đổi số oxi hoá:
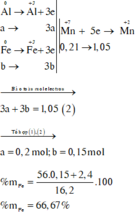

Đáp án B
nSO2 = 1,7 (mol)
Chất rắn Z là Fe2O3, nFe2O3 = 0,4 (mol)
2Febđ → Fe2O3
0,8 ← 0,4 (mol)
Ta có: mX = 1,7 ×64 – 48=60,8 (gam)
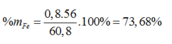
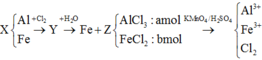
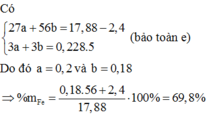
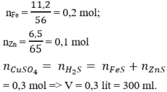
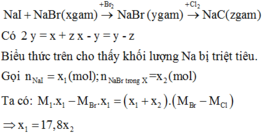
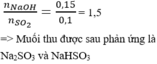

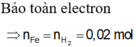
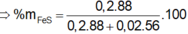
nFe = x mol, nCu = y mol.
Cho toàn bộ Z vào dung dịch H2SO4 (loãng, dư),
sau khi các phản ứng kết thúc thì khối lượng chất rắn giảm 0,28 gam và dung dịch thu được chỉ chứa
một muối duy nhất. ==> chất rắn Z gồm Fe dư và Cu , khi cho qua H2SO4 loãng chất rắn giảm chính là Fe dư vì Cu ko phản ứng vs H2SO4 lãng mà dd sau đó lại chỉ chứa 1 muối.
nFe(dư) = 0,28/56 = 0,005 mol.
vì khi cho Fe vào Zn và dd CuSO4 Zn fản ứng hết thì mới tới Fe
và 1mol Fe---> 1mol Cu mhh tăng 8g , 1mol Zn ---> 1mol Cu mhh giảm 1 gam.
dùng tăng giảm khối lượng : (x - 0,005).8 - y = 0,14 (1)
và tổng khối lượng hh ban đầu = 2,7 ==> 56x + 65y = 2,7(2)
giải (1) và (2) ra x = 0,025 và y = 0,02.
%Fe = 0,025.56/(0,025.56 + 0,02.64). 100 = 52,24%
vì mZ >mX nên Zn phản ứng hết, Fe phản ứng 1 phần
gọi x, y là mol của Zn và Fe
theo đề bài ta có:
65x +56y+0,28= 2,7 (1)
64(x+y)+0,28=2,84 (2)
từ (1),(2)=>x=0,02
y=0,02
%mFe = (56.0,02+0,28)/2,7=51,85%