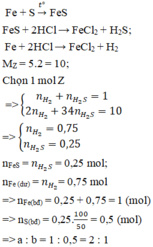Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Các PTHH:
Fe + S → FeS (1)
FeS + 2HCl → Fe Cl 2 + H 2 S (2)
Fe(dư) + 2HCl → Fe Cl 2 + H 2 (3)
HCl (dư) + NaOH → NaCl + H 2 O (4)
Thành phần của hỗn hợp khí A :
Theo (1) : 0,05 mol Fe tác dụng với 0,05 mol S, sinh ra 0,05 mol FeS.
Theo (2) : 0,05 mol FeS tác dụng với 0,10 mol HCl, sinh ra 0,05 mol H 2 S
Theo (3) : 0,05 moi Fe dư tác dụng với 0,10 mol HCl, sinh ra 0,05 mol HCl
Kết luận : Hỗn hợp khí A có thành phần phần trăm theo thể tích :
50% khí H 2 S và 50% khí H 2

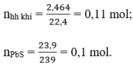
a) Phương trình hóa học của phản ứng:
Fe + 2HCl → FeCl2 + H2 (1)
FeS + 2HCl → FeCl2 + H2S (2)
H2S + Pb(NO3)2 → PbS + 2HNO3 (3)
b) Hỗn hợp khí thu được là H2 và H2S
Theo pt (3) ⇒ nH2S = nPbS = 0,1 mol
⇒ nH2 = nhh khí - nH2S = 0,11 – 0,1 = 0,01 mol
VH2 = 0,01 x 22,4 = 0,224l.
VH2S = 0,1 x 22,4 = 2,24l.
c) Theo PT (2) ⇒ nFeS = nH2S = 0,1 mol
⇒ mFeS = 0,1 × 88 = 8,8g.
Theo PT (1) nFe = nH2 = 0,01 mol ⇒ mFe = 56 × 0,01 = 0,56g.

a)Fe + 2HCl ->FeCl2 + H2\(\uparrow\)
0.01 0.01
FeS + 2HCl ->FeCl2 + H2S\(\uparrow\)
0.1 0.1
H2S + Pb(NO3)2->PbS \(\downarrow\) + 2HNO3
0.1 0.1
nPbS =2.39/239=0.1 mol , n (hỗn hợp khí) =2.464/22.4=0.11 mol
n(H2)+n(H2S)=0.11 ->n(H2)=0.01 mol
V(H2)=n * 22.4 = 0.01*22.4=0.224(l)
V(H2S)=n*22.4=0.1*22.4=2.24(l)
m(Fe)=n*M=0.01*56=0.56(g)
m(FeS)=n*M=0.1*88=8.8(g)

Do hòa tan X vào dd HCl dư thu được hỗn hợp khí
=> Trong X chứa Fe
\(n_{Fe}=\dfrac{16,8}{56}=0,3\left(mol\right)\); \(n_S=\dfrac{6,4}{32}=0,2\left(mol\right)\)
PTHH: Fe + S --to--> FeS
0,2<-0,2---->0,2
Fe + 2HCl --> FeCl2 + H2
0,1------------------->0,1
FeS + 2HCl --> FeCl2 + H2S
0,2---------------------->0,2
=> \(\left\{{}\begin{matrix}\%V_{H_2}=\dfrac{0,1}{0,1+0,2}.100\%=33,33\%\\\%V_{H_2S}=\dfrac{0,2}{0,1+0,2}.100\%=66,67\%\end{matrix}\right.\)
\(n_{Fe}=\dfrac{16,8}{56}=0,3\left(mol\right)\\ n_S=\dfrac{6,4}{32}=0,2\left(mol\right)\)
PTHH: Fe + S --to--> FeS
LTL: 0,3 > 0,2 => Fe dư
Theo pthh: nFe (pư) = nS = nFeS = 0,2 (mol)
=> nFe (dư) = 0,3 - 0,2 = 0,1 (mol)
PTHH:
Fe + 2HCl ---> FeCl2 + H2
0,1------------------------->0,1
FeS + 2HCl ---> FeCl2 + H2S
0,2--------------------------->0,2
=> \(\left\{{}\begin{matrix}\%V_{H_2}=\dfrac{0,1}{0,1+0,2}.100\%=33,33\%\\\%V_{H_2S}=100\%-33,33\%=66,67\%\end{matrix}\right.\)

PTHH: \(2Al+3S\underrightarrow{^{t^o}}Al_2S_3\)
Gọi số mol Al là x; S là y.
Ta có phương trình : \(27x+32y=10,2\left(g\right)\)
Vì cho Y tác dụng với HCl thu được hỗn hợp khí nên Al dư
\(\Rightarrow n_{Al_2S_3}=\dfrac{1}{3}n_S=\dfrac{y}{3}\left(mol\right)\)
\(\Rightarrow n_{Al\left(dư\right)}=x-\dfrac{2y}{3}\left(mol\right)\)
PTHH:
\(Al_2S_3+6HCl\rightarrow2AlCl_3+3H_2S\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(\Rightarrow n_{H2S}=3n_{Al2S3}=y\left(mol\right);n_{H2}=\dfrac{3}{2}n_{Al}=1,5x-y\left(mol\right)\)
\(M_Z=18\)
Áp dụng quy tắc đường chéo :
\(\Rightarrow\dfrac{n_{H2S}}{n_{H2}}=\dfrac{16}{16}\Rightarrow1,5x-y=y\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,15\end{matrix}\right.\)
\(\Rightarrow m_{Al}=0,2.27=5,4\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{5,4}{10,2}=52,94\%\\\%m_S=100\%-52,94\%=47,06\%\end{matrix}\right.\)