Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giả sử: \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Al_2O_3}=y\left(mol\right)\end{matrix}\right.\)
⇒ 27x + 102y = 18,54 (1)
Ta có: \(n_{H_2}=\dfrac{4,032}{22,4}=0,18\left(mol\right)\)
Theo ĐLBT mol e, có: 3x = 0,18.2 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,12\left(mol\right)\\y=0,15\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,12.27}{18,54}.100\%\approx17,5\%\\\%m_{Al_2O_3}\approx82,5\%\end{matrix}\right.\)
_ Khi cho hỗn hợp tác dụng với H2SO4 đặc, nóng.
Giả sử: \(n_{SO_2}=a\left(mol\right)\)
Theo ĐLBT mol e, có: 3.0,12 = 2a ⇒ x = 0,18 (mol)
Ta có: \(n_{KOH}=0,36.1=0,36\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{n_{KOH}}{n_{SO_2}}=\dfrac{0,36}{0,18}=2\)
⇒ Pư tạo muối trung hòa K2SO3.
PT: \(SO_2+2KOH\rightarrow K_2SO_3+H_2O\)
___0,18____________0,18 (mol)
\(\Rightarrow C_{M_{K_2SO_3}}=\dfrac{0,18}{0,36}=0,5M\)
Bạn tham khảo nhé!

mO2 = 31,03% . 27,84 = 8,64 (g)
nO2 = 0,135 (mol)
nH2 = 2,24/22,4 = 0,1 (mol)
PTHH:
Al2O3 + 3H2SO4 -> Al2(SO4)3 + 3H2O (1)
2Al + 3H2SO4 -> Al2(SO4)3 + 3H2 (2)
Mg + H2SO4 -> MgSO4 + H2 (3)
Theo PTHH (1): nH2O = nH2SO4 = nO = 0,135 (mol)
Theo PTHH (2)(3): nH2 = nH2SO4 = 0,1 (mol)
mH2SO4 = (0,1 + 0,135) . 98 = 5,264 (g)
mH2O = 0,135 . 18 = 2,43 (g)
mH2 = 0,1 . 2 = 0,2 (g)
Áp dụng ĐLBTKL, ta có:
mAl + mMg + mAl2O3 + mH2SO4 = m(muối) + mH2 + mH2O
=> m(muối) = 27,84 + 5,264 - 0,2 - 2,43 = 30,474 (g)
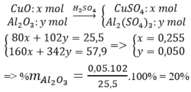
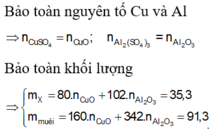
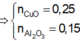
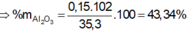
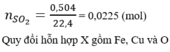
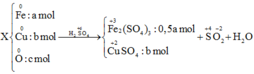
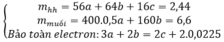
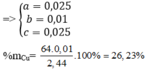




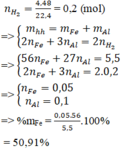
Đáp án D.