Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_K=\dfrac{5,85}{39}=0,15\left(mol\right)\)
PTHH: 2K + 2H2O --> 2KOH + H2
_____0,15------------->0,15-->0,075
=> VH2 = 0,075.22,4 =1,68(l)
mdd = 5,85 + 100 - 0,075.2 = 105,7(g)
=> \(C\%=\dfrac{0,15.56}{105,7}.100\%=7,95\%\)

a) Ta có: \(\left\{{}\begin{matrix}n_{Cu}=\dfrac{0,32}{64}=0,005\left(mol\right)\\n_{H_2}=\dfrac{0,448}{22,4}=0,02\left(mol\right)\end{matrix}\right.\)
Đặt \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow56a+27b=0,87-0,32=0,55\) (1)
Bảo toàn electron: \(2a+3b=2n_{H_2}=0,04\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,005\\b=0,01\end{matrix}\right.\)
Bảo toàn nguyên tố: \(\left\{{}\begin{matrix}n_{FeSO_4}=n_{Fe}=0,005\left(mol\right)\\n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Al}=0,005\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow C_{M_{FeSO_4}}=\dfrac{0,005}{0,3}\approx0,02\left(M\right)=C_{M_{Al_2\left(SO_4\right)_3}}\)
b)
Ta thấy trong 0,87 gam hh X có 0,005 mol Fe, 0,005 mol Cu và 0,01 mol Al
\(\Rightarrow\) Trong 2,61 gam hh X có 0,015 mol Fe, 0,015 mol Cu và 0,03 mol Al
PTHH: \(2Fe+6H_2SO_{4\left(đặc\right)}\xrightarrow[]{t^o}Fe_2\left(SO_4\right)_3+3SO_2\uparrow+6H_2O\)
\(Cu+2H_2SO_{4\left(đặc\right)}\xrightarrow[]{t^o}CuSO_4+SO_2\uparrow+2H_2O\)
\(2Al+6H_2SO_{4\left(đặc\right)}\xrightarrow[]{t^o}Al_2\left(SO_4\right)_3+3SO_2\uparrow+6H_2O\)
Ta có: \(n_{H_2SO_4}=3n_{Fe}+3n_{Al}+2n_{Cu}=0,165\left(mol\right)\)
\(\Rightarrow m_{ddH_2SO_4}=\dfrac{0,165\cdot98}{78\%}\approx20,73\left(g\right)\)

$a)PTHH:2Al+6HCl\to 2AlCl_3+3H_2$
$n_{H_2}=\dfrac{5,04}{22,4}=0,225(mol)$
$\Rightarrow n_{Al}=0,15(mol)$
$\Rightarrow \%m_{Al}=\dfrac{0,15.27}{9,45}.100\%\approx 42,86\%$
$\Rightarrow \%m_{Cu}=100-42,86=57,14\%$
$b)$ Theo PT: $n_{HCl}=2n_{H_2}=0,45(mol)$
$\Rightarrow C_{M_{HCl}}=\dfrac{0,45.110\%}{0,5}=0,99M$

Đáp án B
Đặt
![]()
Khối lượng muối khan giảm là do đã xảy ra phản ứng thay thế các nguyên tử halogen trong muối.
Ta có hệ:
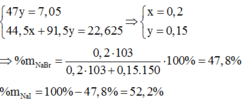

\(n_{HCl}=\dfrac{200.14,6\%}{36,5}=0,8\left(mol\right)\\ Đặt:\left\{{}\begin{matrix}n_{Zn}=x\left(mol\right)\\n_{Mg}=y\left(mol\right)\end{matrix}\right.\\ Zn+2HCl\rightarrow ZnCl_2+H_2\\ Mg+2HCl\rightarrow MgCl_2+H_2\\ Tacó:\left\{{}\begin{matrix}65x+24y=12,5\\x+y=0,35\left(mol\right)\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,25\end{matrix}\right.\\ \Rightarrow m_{Zn}=6,5\left(g\right);m_{Mg}=6\left(g\right)\\ b.Tacó:BTNT\left(H\right):n_{HCl}.1>n_{H_2}.2\\ \Rightarrow HCldưsauphảnứng\\ Dungdịchsauphảnứnggồm:\left\{{}\begin{matrix}ZnCl_2:0,1\left(mol\right)\\MgCl_2:0,25\left(mol\right)\\HCl_{dư}:0,8-0,7=0,1\left(mol\right)\end{matrix}\right.\\ m_{ddsaupu}=200+12,5-0,35.2=212,8\left(g\right)\\ C\%_{ZnCl_2}=\dfrac{0,1.136}{212,8}.100=6,39\%;C\%_{MgCl_2}=\dfrac{0,25.95}{212,8}.100=11,16\%;C\%_{HCl\left(dư\right)}=\dfrac{0,1.36,5}{212,8}.100=1,72\%\)

Gọi kim loại cần tìm là A
a) PTHH: \(A+H_2O\rightarrow AOH+\dfrac{1}{2}H_2\uparrow\)
\(AOH+HCl\rightarrow ACl+H_2O\)
b) Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\) \(\Rightarrow n_A=0,2mol\)
\(\Rightarrow M_A=\dfrac{7,8}{0,2}=39\) \(\Rightarrow\) Kim loại cần tìm là Kali
b) Ta có: \(\left\{{}\begin{matrix}n_{KCl}=0,2mol\\n_{HCl\left(pư\right)}=0,2mol\Rightarrow n_{HCl\left(dư\right)}=0,2\cdot20\%=0,04\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{KCl}=0,2\cdot74,5=14,9\left(g\right)\\m_{HCl\left(dư\right)}=0,04\cdot36,5=1,46\left(g\right)\end{matrix}\right.\)
Mặt khác: \(m_{H_2}=2\cdot0,1=0,2\left(g\right)\)
\(\Rightarrow m_{dd}=m_K+m_{ddHCl}-m_{H_2}=7,8+\dfrac{0,24\cdot36,5}{10\%}-0,2=95,2\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{KCl}=\dfrac{14,9}{95,2}\cdot100\%\approx15,65\%\\C\%_{HCl\left(dư\right)}=\dfrac{1,46}{95,2}\cdot100\%\approx1,53\%\end{matrix}\right.\)

PTHH: R + 2HCl ---> RCl2 + H2 (1)
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
\(n_{HCl}=\dfrac{100}{1000}.5=0,5\left(mol\right)\)
Ta thấy: \(\dfrac{0,2}{1}< \dfrac{0,5}{2}\)
Vậy HCl dư.
Theo PT(1): \(n_R=n_{H_2}=0,2\left(mol\right)\)
=> \(M_R=\dfrac{4,8}{0,2}=24\left(g\right)\)
Vậy R là magie (Mg)
PT: Mg + 2HCl ---> MgCl2 + H2 (2)
Ta có: \(m_{dd_{MgCl_2}}=4,8+\dfrac{100}{1000}-0,2.2=4,5\left(lít\right)\)
Theo PT(2): \(n_{MgCl_2}=n_{H_2}=0,2\left(mol\right)\)
=> \(C_{M_{MgCl_2}}=\dfrac{0,2}{4,5}=\dfrac{2}{45}M\)


Điện thoại mình chụp ảnh hơn mờ nên bạn cố gắng nhìn nge