Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phần 1
2Al +6 HCl ----> 2AlCl3 + 3H2 (1)
Fe + 2HCl ----> FeCl2 + H2 (2)
Cu ko pư với dd HCl
Phần 2
2Al + 2NaOH + 2H20 ---> 2NaAlO2 + 3H2 (3)
Fe và Cu ko pư với dd NaOH
Theo pt(3) n Al = \(\frac{2}{3}\).n H2=\(\frac{2}{3}\). \(\frac{3,36}{22,4}\)=0,1 (mol)
%m Al= \(\frac{0,1.27}{20}\).100%= 13,5%
Theo pt(1)(2) tổng n H2=\(\frac{3}{2}\). nAl + n Fe=\(\frac{5,6}{22,4}\)
==> 0,15 + n Fe = 0,25 ==> n Fe = 0,1 (mol)
%m Fe= \(\frac{0,1.56}{20}\).100%= 28%
%m Cu=100% - 13,5% - 28% =58,5%
tại sao % Al lại đem chia 20 vậy 0,1 mol là ở 1 phần thôi là chia 10 chứ .% Fe cũng thế vậy
==> tổng mAl + mFe trong 1 phần = 0,1.27 + 0,1.56=8,3
%Cu =100% - \(\dfrac{8,3}{10}\).100=17%



Qui đổi ½ hh B gồm Al (x mol), Fe (y mol), O (z mol)

=> mB = 2 (mAl + mFe + mO) = 102,78g
Gọi công thức của oxit sắt là FeaOb

=> Fe2O3

\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Zn + 2HCl -->ZnCl2 + H2
____0,2<----------------------0,2
=> mZn = 0,2.65 = 13 (g)
mCu = mrắn không tan = 19,5 (g)
\(\left\{{}\begin{matrix}\%Zn=\dfrac{13}{13+19,5}.100\%=40\%\\\%Cu=\dfrac{19,5}{13+19,5}.100\%=60\%\end{matrix}\right.\)
`n_(H_2)=4,48/22,4=0,2 (mol)`
Ta có PTHH: `Zn+2HCl --> ZnCl_2 +H_2`
Theo PT: `1`--------------------------------`1`
Theo đề: `0,2`------------------------------`0,2`
`m_(Zn)=0,2.65=13(g)`
Vì `Cu` không phản ứng với `HCl` nên `m_(chất rắn không tan)=m_(Cu)=19,5(gam)`
`%Zn=13/(13+19,5) .100%=40%`
`%Cu=100%-40%=60%`

a)
2Al + 6HCl → 2AlCl3 + 3H2↑
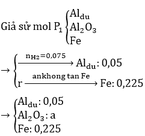
Pt: 2Al + 6H2SO4 → Al2(SO4)3 + 3SO2↑ + 6H2O
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2↑ + 6H2O
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Giả sử P2 = kP1
=> a=0.1
=> m = 128,8g
b)
2yAl + 3FexOy → yAl2O3 + 3xFe
0,1 0,225
=> 0,225y = 0,3x => 3y = 4x
=> Fe3O4

a. PTHH:
\(Cu+H_2SO_4--\times-->\)
\(CuO+H_2SO_4--->CuSO_4+H_2O\left(1\right)\)
\(Cu+2H_2SO_{4_{đặc}}\overset{t^o}{--->}CuSO_4+SO_2+2H_2O\left(2\right)\)
Ta có: \(n_{SO_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Theo PT(2): \(n_{Cu}=n_{SO_2}=0,05\left(mol\right)\)
\(\Rightarrow m_{Cu}=0,05.64=3,2\left(g\right)\)
\(\Rightarrow\%_{m_{Cu}}=\dfrac{3,2}{10}.100\%=32\%\)
\(\%_{m_{CuO}}=100\%-32\%=68\%\)

Gọi số mol của Al và Fe lần lượt là a và b
Ta có 1,5a + b = 0,25
1,5a = 0,15
=> a = 0,1 và b = 0,1
=> %Al = 32,53%
%Fe= 67,47%

2Al + 6HCl → 2 A l C l 3 + 3 H 2
a……….3/2.a (mol)
Mg + 2HCl → M g C l 2 + H 2
b....................b (mol)
4 gam rắn không tan là Cu, gọi số mol của Al và Mg lần lượt là a và b (mol). Ta có:
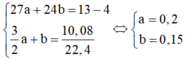
⇒ % m C u = 4 13 .100 = 30,77 % ⇒ % m A l = 0,2.27 13 .100 = 41,54 % ⇒ % m M g = 100 % − 30,77 % − 41,54 % = 27,69 %
⇒ Chọn C.
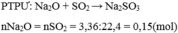

PTHH: \(Na_2O+SO_2\rightarrow Na_2SO_3\)
Ta có: \(n_{SO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)=n_{Na_2O}\)
\(\Rightarrow\%m_{Na_2O}=\dfrac{0,15\cdot62}{20}\cdot100\%=46,5\%\) \(\Rightarrow\%m_{CuO}=53,5\%\)