Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi x là hóa trị của sắt
\(m_{FeCl_x}=\dfrac{10\cdot32,5\%}{100\%}=3,25\left(g\right)\\ n_{AgCl}=\dfrac{8,61}{143,5}=0,06\left(mol\right)\\ PTHH:FeCl_x+AgNO_3\rightarrow Fe\left(NO_3\right)_x+xAgCl\)
Theo PTHH: \(n_{FeCl_x}=\dfrac{n_{AgCl}}{x}=\dfrac{0,06}{x}\left(mol\right)\)
\(\Rightarrow M_{FeCl_x}=\dfrac{3,25}{\dfrac{0,06}{x}}=54x\\ \Rightarrow56+35,5x=54x\\ \Rightarrow x=3\)
Vậy CTHH cần tìm là \(FeCl_3\)

Gọi công thức muối clorua đó là: \(RCl_n\)
\(m_{ct}=60.5,35\%=3,21\)
\(\Rightarrow n_{RCl_n}=\dfrac{3,21}{R+35,5n}\)
\(RCl_n\left(\dfrac{3,21}{R+35,5n}\right)+nAgNO_3\rightarrow R\left(NO_3\right)_n+nAgCl\left(\dfrac{3,21n}{R+35,5n}\right)\)
\(\Rightarrow\dfrac{3,21n}{R+35,5n}=2.0,03\)
\(\Leftrightarrow R=18n\)
Thế \(n=1;2;3;...\) ta nhận \(\left\{{}\begin{matrix}n=3\\R=54\end{matrix}\right.\)
Bài làm của em chưa chính xác. Vì chỉ lấy 1/2 dung dịch RCln tác dụng với AgNO3.
Cô sửa bài cho em rồi nhé ^^

Gọi kim loại có hoá trị 3 là M => CTHH: M2O3
PTHH: M2O3 + 6HCl → 2MCl3 + 3H2O
Khối lượng của HCl là: 250 . 4,38% = 10,95 gam
Số mol của HCl là: 10,95 : 36,5 = 0,3 (mol)
Số mol của M2O3 tính theo phương trình là:
0,3 . \( {1 \over 6}\) = 0,05 (mol)
Số mol của M2O3 tính theo khối lượng là:
5,1 : ( 2. MM + 16 . 3 )
<=> 5,1 : ( 2. MM + 16 . 3 ) = 0,05
<=> MM = 27 (Al)
Gọi CTHH của muối ngậm nước là: AlCl3.xH2O
Số mol của muối AlCl3 là: 0,3 . \( {2 \over 6}\) = 0,1 (mol)
Khi cô cạn dung dịch thì số mol của muối AlCl3 cũng bằng số mol của muối ngậm nước
=> Số mol của muối ngậm nước là: \( {27,75\ \over 133,5 + 18x}\) = Số mol của AlCl3 = 0,01
=> x = 8
Vậy CTHH của muối ngậm nước là: AlCl3.8H2O

Đổi 300ml = 0,3 lít
Ta có: \(n_{H_2SO_4}=5.0,3=1,5\left(mol\right)\)
\(n_{Ba\left(OH\right)_2}=\dfrac{\dfrac{8\%.400}{100\%}}{171}=\dfrac{32}{171}\left(mol\right)\)
a. PTHH: \(Ba\left(OH\right)_2+H_2SO_4--->BaSO_4\downarrow+2H_2O\)
Ta thấy: \(\dfrac{1,5}{1}>\dfrac{\dfrac{32}{171}}{1}\)
Vậy Ba(OH)2 dư, H2SO4 hết.
Theo PT: \(n_{BaSO_4}=n_{H_2SO_4}=1,5\left(mol\right)\)
\(\Rightarrow m_{BaSO_4}=1,5.233=349,5\left(g\right)\)
b. Không có muối tạo thành

nZn=13/65=0,2mol
đổi 200ml=0,2l
pt : Zn + 2 HCl -----> ZnCl2 + H2
npứ: 0,2----->0,4---------->0,2
CM(HCl)=0,4/0,2=2M
CM(ZnCl2) = 0,2/0,2 = 1M
Bài 1:
Zn + 2HCl → ZnCl2 + H2
\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
Theo PT: \(n_{HCl}=2n_{Zn}=2\times0,2=0,4\left(mol\right)\)
\(\Rightarrow C_{M_{HCl}}=\dfrac{0,4}{0,2}=2\left(M\right)\)
Theo PT: \(n_{ZnCl_2}=n_{Zn}=0,2\left(mol\right)\)
\(\Rightarrow C_{M_{ZnCl_2}}=\dfrac{0,2}{0,2}=1\left(M\right)\)
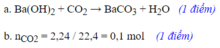
gọi công thức là FeCln
ta có PT : FeCln + nAgNO3 --> nAgCl + Fe(NO3)n
0.06/n <------- 0.06
mFeCln = 3.25(g)
ta có: \(\frac{3.25}{56+35.5n}=\frac{0.06}{n}\)
=>3.25n = 3.36+2.13n
=>1.12n=3.36
=>n=3
vậy CTHH là FeCl3