

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Có: \(NTK_A+16x=4\left(NTK_B+y\right)\) (1)
Xét AOx: \(\%m_O=\dfrac{16x}{NTK_A+16x}.100\%=50\%\)
=> NTKA = 16x (đvC)
Xét BHy: \(\%m_H=\dfrac{y}{NTK_B+y}.100\%=25\%\)
=> NTKB = 3y (đvC)
(1) => 16x + 16x = 4(3y + y)
=> 32x = 16y
=> 2x = y
Do hóa trị của 1 nguyên tố trong hợp chất nằm trong khoảng [1;8]
=> \(1\le y\le8\)
Mà 2x chẵn => y chẵn
=> \(y\in\left\{2;4;6;8\right\}\)
TH1: y = 2 => NTKB = 6 (đvC) --> Loại
TH2: y = 4 => NTKB = 12 (đvC)
=> B là C (Cacbon)
=> BHy là CH4
x = 2 => NTKX = 32 (đvC)
=> X là S (Lưu huỳnh)
=> AOx là SO2
TH3: y = 6 => NTKB = 18 (đvC) --> Loại
TH4: y = 8 => NTKB = 24 (đvC) --> Loại

Đặt x và y lần lượt là số mol của O2 và O3 trong hỗn hợp
2O3 -> 3O2
y 1,5y
Trước phản ứng (x + y) mol hỗn hợp.
Sau phản ứng (x + 1,5y) mol.
Số mol tăng là (x + 1,5y) – (x + y) = 0,5y.
b) 0,5y tương ứng với 2% => y tương ứng với 4%.
Vậy thành phần phần trăm khí oxi là 96% và ozon là 4%.

Ta có; 0,5y ứng với 2% nên y ứng với 4%
Vậy O3 chiếm 4%, O2 chiếm 96%.

a, \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PT: \(R+H_2SO_4\rightarrow RSO_4+H_2\)
Theo PT: \(n_R=n_{H_2}=0,2\left(mol\right)\Rightarrow M_R=\dfrac{11,2}{0,2}=56\left(g/mol\right)\)
→ R là Fe.
b, Dd X gồm FeSO4 và H2SO4 dư.
Ta có: \(n_{FeSO_4}=n_{H_2}=0,2\left(mol\right)\Rightarrow n_{H_2SO_4}=\dfrac{50-0,2.152}{98}=0,2\left(mol\right)\)
Chia X thành 2 phần bằng nhau, mỗi phần có 0,1 (mol) FeSO4 và 0,1 (mol) H2SO4.
- Phần 1:
BTNT S, có: nBaSO4 = nFeSO4 + nH2SO4 = 0,2 (mol)
BTNT Fe, có: nFe2O3 = 1/2.nFeSO4 = 0,05 (mol)
⇒ m = 0,2.233 + 0,05.160 = 54,6 (g)
- Phần 2:
PT: \(10FeSO_4+2KMnO_4+8H_2SO_4\rightarrow5Fe_2\left(SO_4\right)_3+K_2SO_4+2MnSO_4+8H_2O\)
Xét tỉ lệ: \(\dfrac{0,1}{10}< \dfrac{0,1}{8}\) → H2SO4 dư.
Theo PT: \(n_{KMnO_4}=\dfrac{1}{5}n_{FeSO_4}=0,02\left(mol\right)\)
\(\Rightarrow y=C_{M_{KMnO_4}}=\dfrac{0,02}{0,2}=0,1\left(M\right)\)

Khối lượng mol trung bình của hỗn hợp khí:
M = 18 x 2 = 36(g/mol)
Đặt x và y là số mol O 3 và O 2 có trong 1 mol hỗn hợp khí, ta có phương trình đại số :
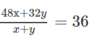
Giải phương trình, ta có y = 3x. Biết rằng tỉ lệ phần trăm về số mol khí cũng là tỉ lệ về thể tích : Thể tích khí oxi gấp 3 lần thể tích khí ozon. Thành phần của hỗn hợp khí là 25% ozon và 75% oxi.

Đặt số mol O2 ban đầu và số mol O3 ban đầu lần lượt là a mol và b mol.
Xét 1 mol hỗn hợp ⇒a+b=1⇒a+b=1
2O3→3O2b→1,5b2O3→3O2b→1,5b
Vì O3 đã bị phân hủy hết nên sau phản ứng:
Quảng cáo
O2 (a + 1,5b) (mol)
Số mol khí tăng thêm: (a + 1,5b) – (a + b) = 0,5b mol
Theo đề bài:
%Vtăng thêm = 0,5b.100(a+b)=2⇒b=0,04⇒a=0,940,5b.100(a+b)=2⇒b=0,04⇒a=0,94
Thành phần phần trăm thể tích các khí trong hỗn hợp đầu
%VO3=0,04.1001=4%,%VO2=96%