Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Fe + H2SO4 ---> FeSO4 + H2
0,2<---------------------------0,2
\(\rightarrow\left\{{}\begin{matrix}m_{Fe}=0,2.56=11,2\left(g\right)\\m_{Cu}=16-11,2=4,8\left(g\right)\end{matrix}\right.\)
b, \(\left\{{}\begin{matrix}n_{Fe}=\dfrac{32}{16}.0,2=0,4\left(mol\right)\\n_{Cu}=\dfrac{4,8}{64}.\dfrac{32}{16}=0,15\left(mol\right)\end{matrix}\right.\)
PTHH:
Cu + 2H2SO4 (đặc, nóng) ---> CuSO4 + SO2 + 2H2O
0,15--------------------------------------------->0,15
2Fe + 6H2SO4 (đặc, nóng) ---> Fe2(SO4)3 + 3SO2 + 6H2O
0,4------------------------------------------------------>0,6
=> VSO2 = (0,6 + 0,15).22,4 = 16,8 (l)
c, \(n_{NaOH}=0,375.2=0,75\left(mol\right)\)
\(T=\dfrac{0,75}{0,6+0,15}=1\) => tạo duy nhất muối axit (NaHSO3)
PTHH: NaOH + SO2 ---> NaHSO3
0,75----------------->0,75
=> mmuối = 0,75.104 = 78 (g)

Đáp án C.
Kim loại không phản ứng với H2SO4 loãng là Cu.
Gọi nCu = x, nMg = y, nAl = z
Ta có:
64x + 24y + 27z = 33,2 (1)
Bảo toàn e:
2nMg + 3nAl = 2nH2
=> 2y + 3z = 2.1 (2)
2nCu = 2nSO2 => x = 0.2 (mol) (3)
Từ 1, 2, 3 => x = 0,2; y = z = 0,4 (mol)
mCu = 0,2.64 = 12,8 (g)
mMg = 0,4.24 = 9,6 (g)
mAl = 10,8 (g)

Mg + H2SO4 -- > MgSO4 + H2
1 1 1 1 (mol)
0,2 0,2 0,2 0,2 (mol)
nH2 = 4,48 / 22,4 = 0,2 (mol)
A + 2H2SO4 ( đặc nóng ) --> ASO4 + SO2 + 2H2O
1 2 1 1 2 (mol)
0,4 0,4 (mol)
nSO2 = 8,96 / 22,4 = 0,4 (mol)
Theo đề ta có :
24.0,2 + A.0,4 = 30,4
=> A = 64 => kim loại A là Cu
Mg + 2H2SO4 ( đặc nóng )---> MgSO4 + SO2 + 2H2O
1 2 1 1 2 (mol)
0,2 0,2 (mol)
Cu + 2H2SO4 ( đặc nóng ) ---> CuSO4 + SO2 + 2H2O
1 2 1 1 2 (mol)
0,4 0,4 (mol)
nSO2 = 0,2+0,4 = 0,6 (mol)
= > VSO2 = 0,6 . 22,4 = 13,44 (l)
mMgSO4 = 0,2 . 120 = 24 (g)
mCuSO4 = 0,4.160 = 64 (g)
mSO2 (cả pứ ) = 0,6.64 = 38,4 (g)
mdd = mhhkl + mddH2SO4 - mSO2
= 30,4 + 200 - 38,4 = 192 (g)
=> \(C\%_{ddMgSO_4}=\dfrac{24.100}{192}=12,5\%\)
\(C\%_{ddCuSO_4}=\dfrac{64.100}{192}=33,33\%\)

\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(FeO+H_2SO_4\rightarrow FeSO_4+H_2O\)
\(n_{H_2}=n_{Fe}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
=> \(n_{FeO}=\dfrac{12,8-56.0,1}{72}=0,1\left(mol\right)\)
12,8 g hh X ------> 0,1 mol Fe và 0,1 mol FeO
=> 6,4g hh X ------> 0,05 mol Fe và 0,05 mol FeO
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O
2FeO + 4H2SO4 → 4H2O + Fe2(SO4)3 + SO2
=> \(n_{SO_2}=\dfrac{3}{2}n_{Fe}+\dfrac{1}{2}n_{FeO}=0,1\left(mol\right)\)
SO2 + Ca(OH)2→ CaSO3 + H2O
Vì kết tủa nên khối lượng dung dịch giảm : \(m_{thêm}-m_{mất}=0,1.64+0,1.74-0,1.120=1,8\left(g\right)\)
Fe+ H2SO4 -> FeSO4 + H2
0,1___0,1______0,1__0,1(mol)
FeO+ H2SO4-> FeSO4 + H2O
=>mFe= 0,1.56=5,6(g)
=>%mFe=(5,6/12.8).100=43.75%
=>%mFeO=56,25%
6,4gam hh X => Số mol giảm đi 1/2
nFe=0,05(mol)=nCu
PTHH: 2 Fe + 6 H2SO4(đ)-to-> Fe2(SO4)3 + 3 SO2 + 6 H2O
0,05_______0,15__________0,025________0,075(mol)
Cu+ 2 H2SO4(đ) -to-> CuSO4 + SO2 + H2O
0,05___0,1_________0,05____0,05(mol)
=> nSO2=0,125(mol)
PTHH: SO2 + Ca(OH)2 -> CaSO3 + H2O
0,125_______0,125_____0,125(mol)
=> KL dung dịch giảm.
KL giảm:
0,125.64 + 0,125.74 - 0,125.120=2,25(g)
Chúc em học tốt!

\(Mg + H_2SO_4 \to MgSO_4 + H_2\\ 2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2\\ Zn + H_2SO_4 \to ZnSO_4 + H_2\\ n_{H_2} = n_{H_2SO_4} = a(mol)\\ \text{Bảo toàn khối lượng : }\\ 20 + 98a = 58,4 + 2a\\ \Rightarrow a = 0,4\\ \Rightarrow V_1 = \dfrac{0,4}{0,5} = 0,8(lít) = 800(ml)\\ V_2 = 0,4.22,4 = 8,96(lít)\)

Đặt nZn = x mol; nFe = y mol.
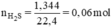
Ta có hệ phương trình: 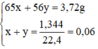
Giải hệ phương trình trên ta được:
x = 0,04 mol, y = 0,02 mol.
mZn = 65 × 0,04 = 2,6g
mFe = 56 × 0,02 = 1,12g

Bài 3 :
a) $Mg + H_2SO_4 \to MgSO_4 + H_2$
$n_{Mg} = n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)$
$\%m_{Mg} = \dfrac{0,15.24}{13,2}.100\% = 27,27\%$
$\%m_{Cu} = 100\% -27,27\% = 72,73\%$
b) $n_{Cu} = \dfrac{13,2 - 0,15.24}{64}= 0,15(mol)$
$\Rightarrow m_{muối} = 0,15.120 + 0,15.160= 42(gam)$
Bài 4 :
Gọi $n_{Fe} = a(mol) ; n_{Mg} = b(mol)$
$56a + 24b = 18,4(1)$
$Fe + 2HCl \to FeCl_2 + H_2$
$Mg + 2HCl \to MgCl_2 + H_2$
Theo PTHH : $n_{H_2} = a + b = \dfrac{11,2}{22,4} = 0,5(2)$
Từ (1)(2) suy ra a = 0,2 ; b = 0,3
$\%m_{Fe} = \dfrac{0,2.56}{18,4}.100\% = 60,87\%$
$\%m_{Mg} = 100\% -60,87\% = 39,13\%$
b) $n_{HCl} = 2n_{H_2} = 1(mol)$
$V_{dd\ HCl} = \dfrac{1}{0,8}= 1,25(lít)$

PTHH: \(2Fe+6H_2SO_{4\left(đ\right)}\underrightarrow{t^o}Fe_2\left(SO_4\right)_3+3SO_2\uparrow+6H_2O\)
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
a) Ta có: \(n_{SO_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\) \(\Rightarrow n_{Fe}=\dfrac{1}{15}\left(mol\right)\)
\(\Rightarrow\%m_{Fe}=\dfrac{\dfrac{1}{15}\cdot56}{13,6}\cdot100\%\approx27,45\%\) \(\Rightarrow\%m_{CuO}=72,55\%\)
b) Ta có: \(m_{CuO}=13,6-\dfrac{1}{15}\cdot56\approx9,9\left(g\right)\) \(\Rightarrow n_{CuO}=n_{H_2SO_4}=\dfrac{9,9}{80}=0,12375\left(mol\right)\)
*Làm gì có H2SO4 loãng đâu nhỉ ??

a) Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Zn}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow56a+65b=12,1\) (1)
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Bảo toàn electron: \(2n_{Fe}+2n_{Zn}=2n_{H_2}\) \(\Rightarrow2a+2b=0,4\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,1\cdot56}{12,1}\cdot100\%\approx46,28\%\\\%m_{Zn}=53,72\%\end{matrix}\right.\)
b)
Bảo toàn nguyên tố: \(\left\{{}\begin{matrix}n_{FeSO_4}=n_{Fe}=n_{Zn}=n_{ZnSO_4}=0,1\left(mol\right)\\n_{H_2SO_4\left(p.ứ\right)}=n_{H_2}=0,2\left(mol\right)\Rightarrow\Sigma n_{H_2SO_4}=0,2\cdot110\%=0,22\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{FeSO_4}=0,1\cdot152=15,2\left(g\right)\\m_{ZnSO_4}=0,1\cdot161=16,1\left(g\right)\\m_{H_2}=0,2\cdot2=0,4\left(g\right)\\m_{H_2SO_4\left(dư\right)}=\left(0,22-0,2\right)\cdot98=1,96\left(g\right)\end{matrix}\right.\)
Mặt khác: \(m_{dd}=m_{KL}+m_{ddH_2SO_4}-m_{H_2}=211,7\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{FeSO_4}=\dfrac{15,2}{211,7}\cdot100\%\approx7,18\%\\C\%_{ZnSO_4}=\dfrac{16,1}{211,7}\cdot100\%\approx7,61\%\\C\%_{H_2SO_4}=\dfrac{1,96}{22,4}\cdot100\%\approx0,93\%\end{matrix}\right.\)
Fe tan trong H2SO4 => phần ko tan trong H2SO4 loãng là R
nH2= \(\frac{4,48}{22,4}\)=0,2 mol
Fe + H2SO4 ----> FeSO4 +H2
0,2..........................................0,2
mR=17,6-56*0,2=6,4 (g)
gọi n là hóa trị của R; nSO2 =\(\frac{2,24}{22,4}\)=0,1 mol
2R +2nH2SO4 -----> R2(SO4)n + nSO2 +2nH2O
\(\frac{0,2}{n}\).....................................................0,1
=> MR = 6,4 : \(\frac{0,2}{n}\)=32n
biện luận
=> R là Cu
chọn D
cảm ơn nhìu nha