Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

mCa(OH)2 = 7.4 g
nCa(OH)2 = 0.1 mol
Ca(OH)2 + 2HCl --> CaCl2 + 2H2O
0.1________________0.1
mCaCl2 = 0.1*111 = 11.1 g
=> mM còn lại = 46.35 - 11.1 = 35.25 g
Đặt :
nFe2O3 = x mol
nMgO = y mol
<=> 160x + 40y = 16 (1)
Fe2O3 + 6HCl --> 2FeCl3 + 3H2O
x_________________2x
MgO + 2HCl --> MgCl2 + H2O
y_______________y
<=> 325x + 95y = 35.25 (2)
(1) và (2) :
x =0.05
y = 0.2
mFe2O3 = 8 g
mMgO = 8 g
%Fe2O3 = %MgO = 8/16*100% = 50%
PTHH: Fe2O3 + 6HCl ---> 2FeCl3 + 3H2O
Mol: x 6x 2x 3x
MgO + 2HCl ---> MgCl2 + H2O
Mol: y 2y y y
2HCl + Ca(OH)2 ---> H2O + CaCl2
Mol: 0,2 0,1 0,1 0,1
mCa(OH)2 = 14,8%*50 / 100% = 7,4g
nCa(OH)2 = 7,4 / 74 = 0,1 mol
Gọi x, y là số mol của Fe2O3, MgO
mhh = 160x + 40y = 16 (1)
mmuối = 162,5 * 2x + 95y = 35,25 (2)
Giải pt (1), (2) ==> x = 0,05 y = 0,2
%mFe2O3 = 160*0,05*100%/ 16 = 50%
%mMgO = 100% - 50% = 50%

Ở phần b, nếu trong hỗn hợp đầu thì phải là % khối lượng mỗi oxit chứ nhỉ? Và ở phần c phải là 1,1 g/ml chứ không phải g/mol bạn nhé!


Bạn tham khảo link nhé!
một hỗn hợp gồm Fe2O3 và MgO nặng 16g được hòa tan hết trong udng dịch axit HCL sau đó đem cô cạn dung dịch thu được 35,25g muối khan a) viết các PTHH b) tính thành phần % khối lượng mỗi oxit trong hỗn hợp ban đầu >< giúp với ạ - Hoc24

nHCl (ban đầu) = 0.6(mol)
gọi nK2CO3 = x (mol)
nNa2CO3 = y(mol)
Ta có : x + y = nCO2 = 0.25(mol)
K2CO3 + 2HCl ---> 2KCl + H2O + CO2
x________2x____________________x
Na2CO3 + 2HCl ---> 2NaCl + H2O + CO2
y_________2y____________________y
=> n(HCl pư) = 2 x 0.25 = 0.5(mol)
=> nHCl dư = 0.1(mol) = nNaOH
=> dd thu được gồm : K(+) , Na(+), Cl(-) , Na(+)
Ta có : 78x + 46y = 39.9 - 0.6*35.5 - 23*0.1 = 16.3
=> x = 0.15
y = 0.1
BẠN THAM KHẢO

Trong dd ban đầu:
K+_____a mol
Mg2+___b mol
Na+____c mol
Cl-_____a + 2b + c mol
mhhbđ = 74.5a + 95b + 58.5c = 24.625 g______(1)
nAgNO3 = 0.3*1.5 = 0.45 mol
Cho Mg vào A có phản ứng (theo gt) nên Ag(+) còn dư, Cl(-) hết. Rắn C gồm Ag và có thể cả Mg còn dư nữa. Thật vậy, khi cho rắn C vào HCl loãng thì khối lượng rắn bị giảm đi, chính do Mg pư, Ag thì không. Vậy mrắn C giảm = mMg chưa pư với A = 1.92 g.
=> nMg dư = 1.92/24 = 0.08 mol
=> nMg pư với A = 2.4/24 - 0.08 = 0.02 mol________(*)
Khi cho Mg vào A có pư:
Mg + 2Ag(+) ---> 2Ag(r) + Mg(2+)
0.02__0.04
=> nAg(+) pư với dd ban đầu = 0.45 - 0.04 = 0.41 mol
Ag(+) + Cl(-) ---> AgCl(r)
0.41___0.41
Có: nCl(-) = a + 2b + c = 0.41_____________(2)
Trong các cation trên, Mg(2+) và Ag(+) có pư với OH(-), tuy nhiên trong D chỉ có Mg(2+) nên kết tủa là Mg(OH)2:
Mg(2+) + 2OH(-) ---> Mg(OH)2
Khi nung:
Mg(OH)2 ---> MgO + H2O
Ta có: nMg(2+)trongD = nMgO = 4/40 = 0.1 mol
Trong đó 0.02 mol Mg(2+) được thêm vào bằng cách cho kim loại Mg vào (theo (*)), vậy còn lại 0.08 mol Mg(2+) là thêm từ đầu, ta có:
b = 0.08 mol_________________________(3)
(1), (2), (3) => a = 0.15, b = 0.08, c = 0.1
mKCl = 74.5*0.15 = 11.175 g
mMgCl2 = 95*0.08 = 7.6 g
mNaCl = 58.5*0.1 = 5.85 g

\(M_2CO_3+2HCl\rightarrow2MCl+H_2O+CO_2\)
a---------->2a--------------------------->a
\(MHCO_3+HCl\rightarrow MCl+H_2O+CO_2\)
b---------->b---------------------------->b
\(NaOH+HCl\rightarrow NaCl+H_2O\)
0,1----->0,1
\(\left\{{}\begin{matrix}a+b=n_{CO_2}=0,3\\2a+b+0,1=0,5\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,2\end{matrix}\right.\)
=> \(0,1\left(2M+60\right)+0,2\left(M+61\right)=27,4\Rightarrow M=23\)
M là Na
Hai muối ban đầu là \(Na_2CO_3,NaHCO_3\)
\(m_{Na_2CO_3}=0,1.106=10,6\left(g\right)\)
\(m_{NaHCO_3}=0,2.84=16,8\left(g\right)\)
b. Trong đề không có đề cập tới V bạn.
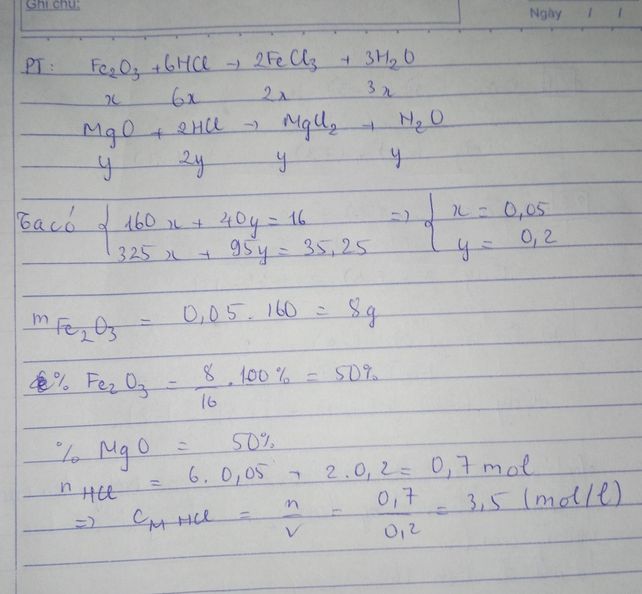
Lê Mạnh Cường Fe3O4 và oxit gì bạn?