
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Fe2(SO4)3+3Ba(OH)2\(\rightarrow\)2Fe(OH)3+3BaSO4
2Fe(OH)3\(\rightarrow\)Fe2O3+3H2O
Ba(OH)2+H2SO4\(\rightarrow\)BaSO4+2H2O
Ta có
ddB+H2SO4 tạo kết tủa \(\rightarrow\)dd B là Ba(OH)2 dư
Kết tủa A gồm Fe(OH)3 và BaSO4
Chất rắn D gồm Fe2O3 và BaSO4
nBaSO4=\(\frac{0,932}{233}\)=0,004 mol
\(\rightarrow\)nBa(OH)2 dư=0,04 mol
Gọi a là số mol Fe2(SO4)3\(\rightarrow\)nBa(OH)2 tham gia=3a mol
nBaSO4=3a mol
nFe2O3=a mol
Ta có
160a+699a=4,295 \(\rightarrow\)a=0,005 mol
\(\rightarrow\) nFe2(SO4)3=0,005 mol
nBa(OH)2=0,005.3+0,004=0,019 mol
CMFe2(SO4)3=\(\frac{0,005}{0,1}\)=0,05 M
CMBa(OH)2=\(\frac{0,019}{0,1}\)=0,19 M

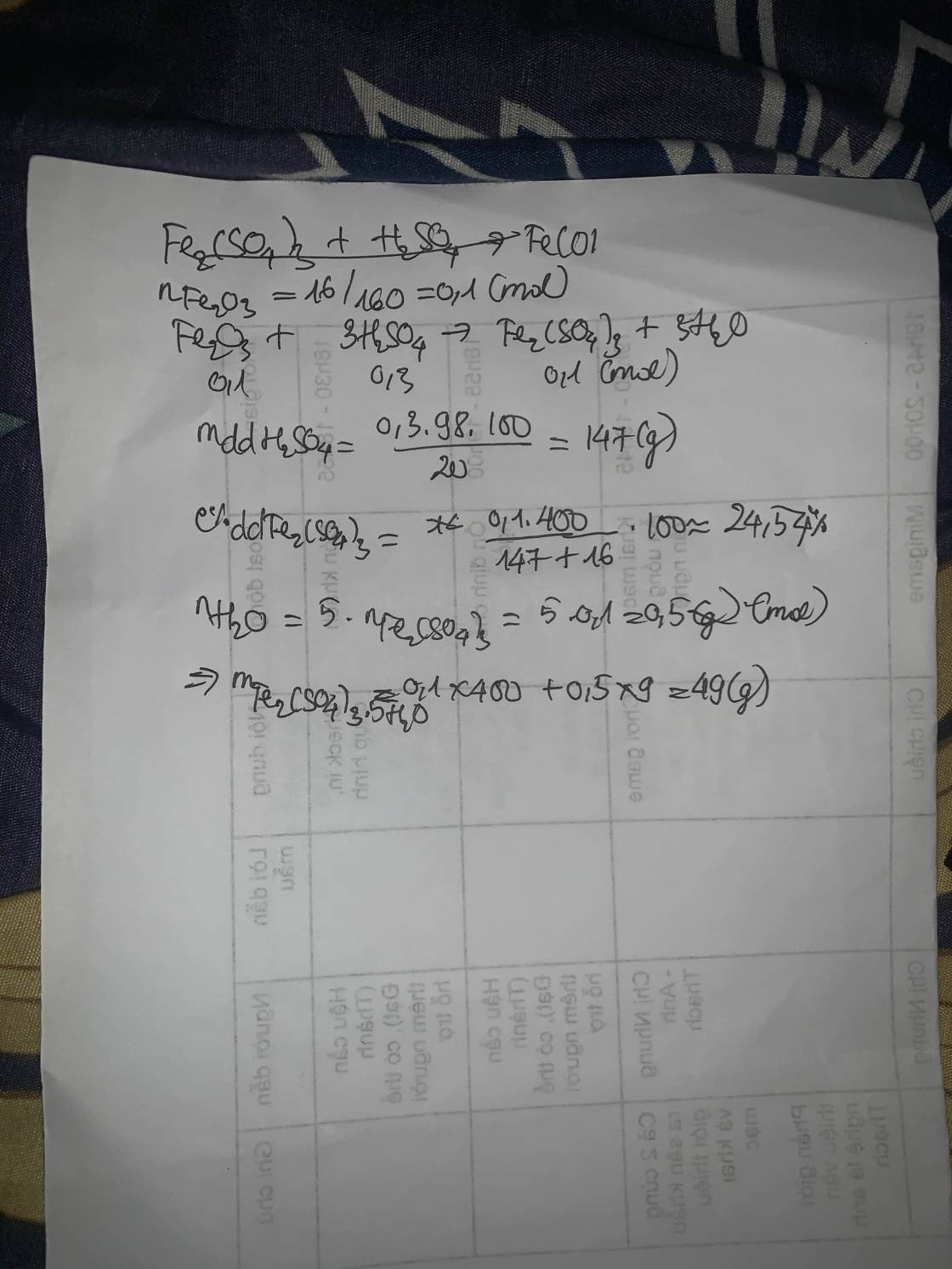
\(n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\)
PT: \(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
a, \(n_{HCl}=6n_{Fe_2O_3}=0,6\left(mol\right)\)
\(\Rightarrow C\%_{HCl}=\dfrac{0,6.36,5}{500}.100\%=4,38\%\)
b, \(n_{FeCl_3}=2n_{Fe_2O_3}=0,2\left(mol\right)\)
PT: \(FeCl_3+3KOH\rightarrow3KCl+Fe\left(OH\right)_{3\downarrow}\)
______0,2_______0,6______________0,2 (mol)
\(\Rightarrow C_{M_{KOH}}=\dfrac{0,6}{0,2}=3\left(M\right)\)
\(m_{Fe\left(OH\right)_3}=0,2.107=21,4\left(g\right)\)

$n_{CuO} = 0,2(mol)$
\(CuO+H_2SO_4\text{→}CuSO_4+H_2O\)
0,2 0,2 0,2 (mol)
$m_{dd\ H_2SO_4} = \dfrac{0,2.98}{20\%} = 98(gam)$
$m_{dd\ A} =16 + 98 = 114(gam)$
Gọi $n_{CuSO_4.5H_2O} = a(mol)$
Sau khi tách tinh thể :
$n_{CuSO_4} = 0,2 - a(mol)$
$m_{dd} = 114 - 250a(gam)$
Suy ra:
$\dfrac{(0,2 - a).160}{114 - 250a} = \dfrac{17,4}{17,4 + 100}$
$\Rightarrow a = 0,1228(mol)$
$m = 0,1228.250 = 30,7(gam)$

nCuO=16/80=0,2(mol)
a) PTHH: CuO + 2HCl-> CuCl2 + H2O
0,2__________0,4________0,2(mol)
b) mHCl=0,4.36,5=14,6(g)
=>mddHCl=(14,6.100)/20=73(g)
c) mCuCl2= 135.0,2=27(g)
mddCuCl2= mCuO + mddHCl= 16+73=89(g)
=> C%ddCuCl2=(27/89).100=30,337%
Câu 9 : Số mol của đồng (II) oxit
nCuO = \(\dfrac{m_{CuO}}{M_{CuO}}=\dfrac{16}{80}=0,2\left(mol\right)\)
a) Pt : CuO + 2HCl → CuCl2 + H2O\(|\)
1 2 1 1
0,2 0,4 0,2
b) Số mol của axit clohidric
nHCl = \(\dfrac{0,2.2}{1}=0,4\left(mol\right)\)
Khối lượng của axit clohidric
mHCl = nHCl . MHCl
= 0,4 . 36,5
= 14,6 (g)
Khối lượng của dung dịch axit clohidric
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{dd}=\dfrac{m_{ct}.100}{C}=\dfrac{14,6.100}{20}=73\left(g\right)\)
c) Số mol cuả đồng (II) clorua
nCuCl2 = \(\dfrac{0,4.1}{2}=0,2\left(mol\right)\)
Khối lượng của đồng (II) clorua
mCuCl2 = nCuCl2 . MCuCl2
= 0,2. 135
= 27 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mCuO + HCl
= 16 + 73
= 89 (g)
Nồng độ phần trăm của đồng (II) clorua
C0/0CuCl2 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{27.100}{89}=30,34\)0/0
Chúc bạn học tốt

Ta có: \(n_{Fe_3O_4}=\dfrac{2,32}{232}=0,01\left(mol\right)\)
a. PTHH: Fe3O4 + 4H2SO4 ---> FeSO4 + Fe2(SO4)3 + 4H2O
Theo PT: \(n_{H_2SO_4}=4.n_{Fe_3O_4}=4.0,01=0,04\left(mol\right)\)
=> \(m_{H_2SO_4}=0,04.98=3,92\left(g\right)\)
Theo đề, ta có: \(C_{\%_{H_2SO_4}}=\dfrac{3,92}{m_{dd_{H_2SO_4}}}.100\%=20\%\)
=> \(m_{dd_{H_2SO_4}}=19,6\left(g\right)\)
b. Ta có: \(m_{dd_{SauPỨ}}=2,32+19,6=21,92\left(g\right)\)
Theo PT: \(n_{FeSO_4}=n_{Fe_2\left(SO_4\right)_3}=n_{Fe_3O_4}=0,01\left(mol\right)\)
=> \(m_{FeSO_4}=0,01.152=1,52\left(g\right)\)
\(m_{Fe_2\left(SO_4\right)_3}=0,01.400=4\left(g\right)\)
=> \(m_{SauPỨ}=1,52+4=5,52\left(g\right)\)
=> \(C_{\%_{SauPỨ}}=\dfrac{5,52}{21,92}.100\%=25,18\%\)

Ta có: \(n_{CuO}=\dfrac{10}{80}=0,125\left(mol\right)\)
PT: \(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
____0,125___0,125____0,125 (mol)
Ta có: \(m_{H_2SO_4}=0,125.98=12,25\left(g\right)\Rightarrow m_{ddH_2SO_4}=\dfrac{12,25}{24,5\%}=50\left(g\right)\)
⇒ m dd sau pư = 10 + 50 = 60 (g)
- Sau khi làm lạnh: m dd = 60 - 15,625 = 44,375 (g)
\(\Rightarrow m_{CuSO_4\left(saulamlanh\right)}=44,375.22,54\%=10\left(g\right)\)
\(\Rightarrow n_{CuSO_4\left(saulamlanh\right)}=\dfrac{10}{160}=0,0625\left(mol\right)\)
Gọi CTHH của T là CuSO4.nH2O
⇒ nT = 0,125 - 0,0625 = 0,0625 (mol)
\(\Rightarrow M_T=\dfrac{15,625}{0,0625}=250\left(g/mol\right)\)
\(\Rightarrow160+18n=250\Rightarrow n=5\)
Vậy: CTHH của T là CuSO4.5H2O

a/ CT oxit: $CuO$
b/ Vậy CT X: $CuSO_4.5H_2O$
Giải thích các bước giải:
Gọi công thức oxit là: $MO$
Số mol oxit là a mol
$MO+H_2SO_4\to MSO_4+H_2O$
Theo PTHH
$n_{H_2SO_4}=n_{MSO_4}=n_{MO}=a\ mol$
$⇒m_{dd\ H_2SO_4}=\dfrac{98a.100}{24,5}=400a$
$⇒m_{dd\ A}=a.(M+16)+400a = aM+416a$
$m_{MSO_4}=a.(M+96)$
Do nồng độ muối là 33,33% nên:
$\dfrac{a.(M+96)}{aM+416a}.100\%=33,33\\⇒M=64$
Vậy M là Cu, công thức oxit: $CuO$
b.
Trong 60 gam dung dịch muối A có:
$m_{CuSO_4}=\dfrac{60.33,33}{100}=20g$
Gọi công thức tinh thể tách ra là: $CuSO_4.nH_2O$
Khối lượng dung dịch còn lại là:
$60-15,625=44,375g ⇒ m_{CuSO_4\ trong\ dd}=\dfrac{44,375.22,54}{100}=10g$
$⇒m_{CuSO_4\ trong\ tinh\ thể}=20-10=10g$
$⇒n_{tinh\ thể}=n_{CuSO_4}=0,0625\ mol$
$⇒M_{tinh\ thể}=15,625:0,0625=250⇒n=5$
Vậy CT X: $CuSO_4.5H_2O$