Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

`2Fe + 6H_2 SO_[4(đ,n)] -> Fe_2(SO_4)_3 + 3SO_2 \uparrow + 6H_2 O`
`0,05` `0,15` `0,025` `(mol)`
`Cu + 2H_2 SO_[4(đ,n)] -> CuSO_4 + SO_2 \uparrow + 2H_2 O`
`0,225` `0,45` `0,225` `(mol)`
`n_[SO_2]=[6,72]/[22,4]=0,3(mol)`
Gọi `n_[Fe]=x` ; `n_[Cu]=y`
`=>` $\begin{cases} \dfrac{3}{2}x+y=0,3\\56x+64y=17,2 \end{cases}$
`<=>` $\begin{cases}x=0,05\\y=0,225 \end{cases}$
`@m_[Fe_2(SO_4)_3]=0,025.400=10(g)`
`@m_[CuSO_4]=0,225.160=36(g)`
`@m_[dd H_2 SO_4]=[(0,15+0,45).98]/80 .100=73,5(g)`
Sửa đề: 80% ---> 98% (80% chưa đặc nên không giải phóng SO2 được)
Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Cu}=b\left(mol\right)\end{matrix}\right.\)
\(\rightarrow56a+64b=17,2\left(1\right)\)
PTHH:
\(2Fe+6H_2SO_{4\left(đặc,nóng\right)}\rightarrow Fe_2\left(SO_4\right)_3+3SO_2\uparrow+6H_2O\)
a------>3a------------------->0,5a--------------->1,5a
\(Cu+2H_2SO_{4\left(đặc,nóng\right)}\rightarrow CuSO_4+SO_2\uparrow+2H_2O\)
b----->2b------------------->b------------->b
\(\rightarrow1,5a+b=\dfrac{6,72}{22,4}=0,3\left(2\right)\)
Từ \(\left(1\right)\left(2\right)\rightarrow\left\{{}\begin{matrix}a=0,05\left(mol\right)\\b=0,225\left(mol\right)\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}m_{Fe_2\left(SO_4\right)_3}=0,5.0,05.400=10\left(g\right)\\m_{CuSO_4}=0,225.160=36\left(g\right)\\m_{ddH_2SO_4}=\dfrac{\left(0,05.3+0,225.2\right).98}{98\%}=60\left(g\right)\end{matrix}\right.\)

Đáp án D
Số mol thu được là: n SO 2 = 6 , 72 22 , 4 = 0 , 3 mol
Sơ đồ phản ứng: Fe 0 ⏟ m gam + H 2 S + 6 O 4 ( đặc , dư ) → t 0 Fe + 3 2 ( SO 4 ) 3 + SO 2 + 4 ⏟ 0 , 3 mol ↑ + H 2 O
Các quá trình nhường, nhận electron:
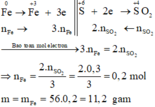

Đáp án A.
Gọi nAl = a mol, nZn = b mol.

Ta có: 27a + 65b = 9,2 (*)
3a + 2b = 0,5 (**)
Giải (*), (**): a = b = 0,1 mol.
m muối = mKl + M gốc axit. ne/2
= 3,92 + 96. 0,25 = 33,2 g

Đáp án A
Gọi số mol các kim loại là Al: a mol; Fe: b mol.
Ta có:
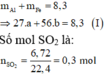
Sơ đồ phản ứng:
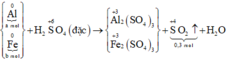
Các quá trình nhường, nhận electron:



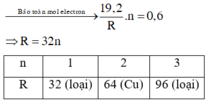
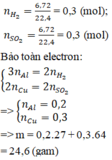


\(n_{SO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: 2Fe + 6H2SO4(đặc, nóng) ---> Fe2(SO4)3 + 3SO2 + 6H2O
0,1<---------0,3
=> mFe2(SO4)3 = 0,1.400 = 40 (g)
\(nFe=\dfrac{15,12}{56}=0,27\left(mol\right)\)
\(nSO_2=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
2Fe+6H\(_2\)SO\(_4\)> Fe\(_2\)(SO4)\(_3\)+H\(_2\)O+3SO\(_2\)
LTL : 0,27/2 < 0,3/3
=> Fe td hết
=> \(nFe_2\left(SO_4\right)_3=\dfrac{1}{2}.nFe=\dfrac{1}{2}.0,27=0,135\left(mol\right)\)
=> \(m\left(muối\right)=mFe_2\left(SO_4\right)_3=0,135.400=54\left(g\right)\)