Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Zn}=\dfrac{m}{M}=\dfrac{3,25}{65}=0,05\left(mol\right)\)
\(PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\)
1 2 1 1
0,05 0,1 0,05 0,05
a) \(V_{H_2}=n.24,79=0,05.24,79=1,2395\left(l\right)\)
\(m_{ZnCl_2}=n.M=0,05.\left(65+35,5.2\right)=6,8\left(g\right)\)
b) \(PTHH:CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Ta cos tỉ lệ: \(\dfrac{0,1}{1}>\dfrac{0,05}{1}\Rightarrow\) CuO dư.
Theo ptr, ta có: \(n_{Cu}=n_{H_2}=0,05mol\\ \Rightarrow m_{Cu}=n.M=0,05.64=3,2\left(g\right).\)
a, PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Ta có: \(n_{Zn}=\dfrac{3,25}{65}=0,05\left(mol\right)\)
THeo PT: \(n_{ZnCl_2}=n_{H_2}=n_{Zn}=0,05\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,05.24,79=1,2395\left(l\right)\)
\(m_{ZnCl_2}=0,05.136=6,8\left(g\right)\)
b, Ta có: \(n_{CuO}=\dfrac{8}{80}=0,1\left(mol\right)\)
PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Xét tỉ lệ: \(\dfrac{0,1}{1}>\dfrac{0,05}{1}\), ta được CuO dư.
Theo PT: \(n_{Cu}=n_{H_2}=0,05\left(mol\right)\Rightarrow m_{Cu}=0,05.64=3,2\left(g\right)\)

Hiện tượng : kẽm bị tan dần , có khí không màu thoát ra .
Zn + 2HCl ---> ZnCl2 + H2
0,1 0,2 0,1 0,1
nZn = 6,5 / 65 = 0,1 ( mol )
V H2 = \(\dfrac{n.R.t}{p}=\dfrac{0,1.0,082.\left(273+25\right)}{1}=2,4436\left(l\right)\)
H2 + CuO ---> Cu + H2O
0,1 0,1
=> mCu = 0,1 . 64 = 6,4 (g)

\(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\\
pthh:Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1 0,1
\(m_{HCl}=0,2.36,5=7,3\left(g\right)\\
V_{H_2}=0,1.22,4=2,24l\\
m_{\text{dd}}=6,5+200-\left(0,1.2\right)=206,3g\)
bài 2 :
\(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\\
pthh:Mg+2HCl\rightarrow MgCl_2+H_2\)
0,2 0,4 0,2 0,2
\(m_{HCl}=0,4.36,5=14,6g\\
V_{H_2}=0,2.22,4=4,48l\\
m\text{dd}=4,8+200-0,4=204,4g\\
C\%=\dfrac{0,2.136}{204,4}.100\%=13,3\%\)

a, \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
____0,2____________0,2____0,2 (mol)
\(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
b, \(m_{ZnCl_2}=0,2.136=27,2\left(g\right)\)
c, \(n_{CuO}=\dfrac{8}{80}=0,1\left(mol\right)\)
PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,2}{1}\), ta được H2 dư.
Theo PT: \(n_{Cu}=n_{CuO}=0,1\left(mol\right)\Rightarrow m_{cr}=m_{Cu}=0,1.64=6,4\left(g\right)\)

nFe = 16,8/56 = 0,3 (mol)
PTHH: Fe + 2HCl -> FeCl2 + H2
Mol: 0,3 ---> 0,6 ---> 0,3 ---> 0,3
VH2 = 0,3 . 24,79 = 7,437 (l)
mHCl = 0,6 . 36,5 = 21,9 (g)
PTHH: CuO + H2 -> (t°) Cu + H2O
Mol: 0,3 <--- 0,3 ---> 0,3
mCu = 0,3 . 64 = 19,2 (g)
mFe = 16,8: 56 =0,3(mol)
pthh : Fe + 2HCl --> FeCl2 + H2 (1)
0,3 ->0,6-----------------> 0,3 (mol)
=> VH2 (đkc) = 0,3 . 24,79 ( l)
=> mHCl = 0,6 . 35,5 = 21,9 (g)
pthh : CuO + H2 -t--> Cu+ H2O
0,3<-----0,3 (mol)
=>mCu = 0,3 . 64 = 19,2 (g)

nMg = 6/24 = 0,25 (mol)
PTHH: Mg + 2HCl -> MgCl2 + H2
nH2 = 0,25 (mol(
VH2 = 0,25 . 24,79 = 6,1975 (l)
CuO + H2 -> (t°) Cu + H2O
nCu = 0,25 (mol)
mCu = 0,25 . 64 = 16 (g)
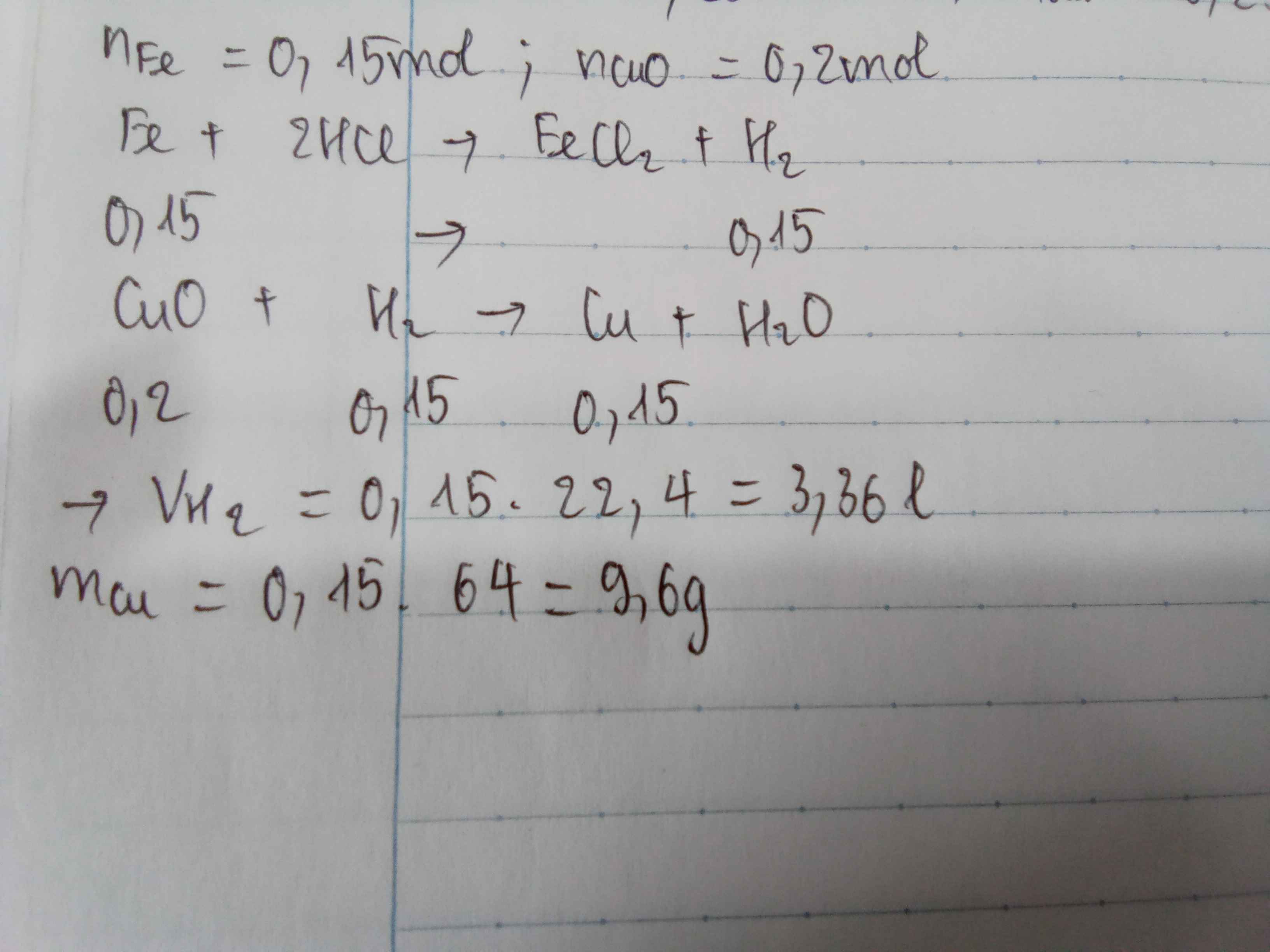

\(n_{Zn}=\dfrac{13}{65}=0,2mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,2 0,4 0,2 0,2
\(V_{H_2}=0,2\cdot22,4=4,48l\)
\(m_{HCl}=0,4\cdot36,5=14,6g\)
c)Cho dẫn qua copper (ll) oxit:
\(CuO+H_2\rightarrow Cu+H_2O\)
0,2 0,2 0,2 0,2
\(m_{Cu}=0,2\cdot64=12,8g\)